服务热线:15229257682
国内唯一的高脂细胞添加剂综合服务商


西安鲲创科技发展有限公司
西安鲲创科技发展有限公司
技术文献
您的位置:
首页 >>
技术文献
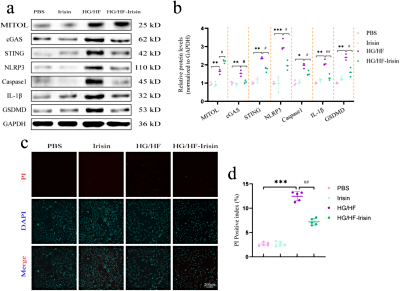
IF/7.5:高糖高脂刺激H9c2心肌细胞模拟DCM(糖尿病心肌病)微环境
H9c2心肌细胞暴露于HG/HF(25mM葡萄糖+300μM棕榈酸)模拟DCM微环境,通过JC-1检测线粒体膜电位、PI/Hoechst染色量化焦亡率、Westernblot分析MITOL/STING/GSDMD-N蛋白表达,并分别采用siRNA敲低MITOL、药物调控STING活性,验证鸢尾素通过MITOL抑制STING依赖性焦亡的机制。
2025-07-16
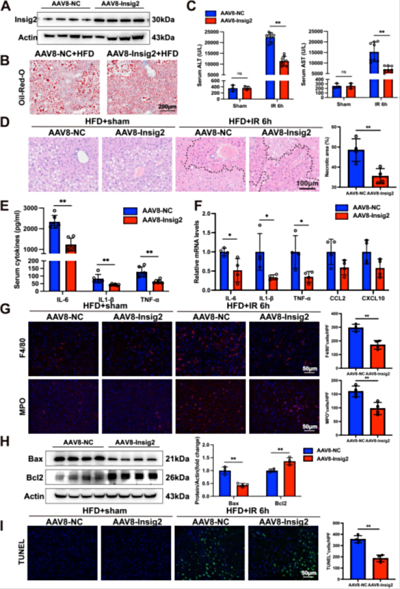
原代肝细胞体外脂肪变性诱导方法(IF/6.1)
细胞实验内容中,分离的原代肝细胞经油酸(钠)/棕榈酸(钠)处理诱导脂肪变性,以模拟体内病理环境。通过缺氧/复氧(H/R)模拟IRI,检测Insig2敲低或过表达对炎症因子(IL-6、IL-1β、TNF-α)、凋亡蛋白(Bax/Bcl-2、Cleaved-caspase3)及铁死亡标志物(PTGS2、ALOX12)的影响。药理学干预(Fer-1、RSL3)进一步验证Insig2-GPX4通路的功能。
2025-06-25
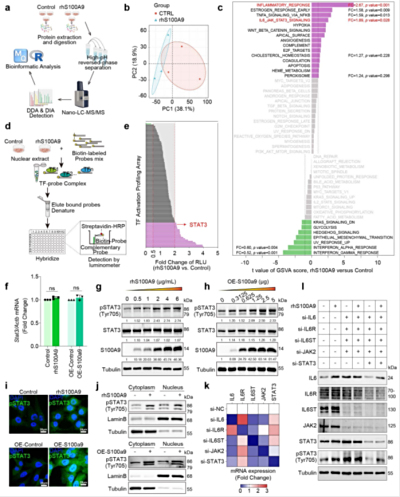
IF/8.2:棕榈酸钠诱导心肌细胞损伤以建立糖尿病心肌病细胞模型
巨噬细胞-心肌细胞相互作用作为糖尿病心肌病(DCM)潜在的干预靶点仍有待深入研究。单细胞分析发现,糖尿病心肌细胞和巨噬细胞中S100 A9作为一种免疫炎症介质表达上调。此外,糖尿病小鼠外周血和心脏中F4/80+ CCR 2 + S100 A9+巨噬细胞均增加。通过帕喹莫德或巨噬细胞耗竭(氯膦酸盐)阻断S100 A9减轻了糖尿病诱导的心功能障碍、炎性巨噬细胞浸润、血清促炎细胞因子。更重要的是,糖尿病性心功能不全、心肌重塑和炎症可以通过巨噬细胞特异性S100 A9敲除(S100 a9 flox/S100 Lyz 2-Cre)来抑制。S100 A9激活导致线粒体过度分裂,线粒体自噬通量降低,线粒体氧化应激升高。此外,蛋白质组学和转录因子谱阵列揭示了S100 A9在心肌细胞中激活STAT 3。然而,这些作用被STAT 3(Y 705 F)突变、STAT 3敲低或帕喹莫德减轻。研究强调了巨噬细胞来源的S100 A9作为糖尿病心功能障碍中线粒体质量控制受损的关键介质,靶向S100 A9代表了一个有前途的治疗靶点。
2025-06-12
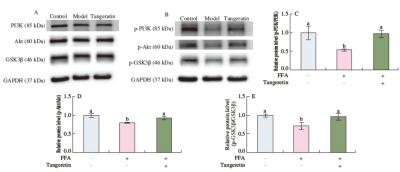
建立HepG2细胞脂质沉积模型以模拟高脂环境下的代谢失衡(中科院1区)
本研究采用油酸与棕榈酸(2:1)混合FFA诱导HepG2细胞脂质沉积模型,通过CCK-8评估陈皮活性成分(如川橘皮素)的细胞毒性,油红O染色和TG含量测定量化脂滴积累,qPCR及Western blot检测PI3K/Akt/GSK3β通路关键基因(如PI3K、Akt、GLUT4)及蛋白磷酸化水平变化,验证网络药理预测结果。
2025-05-29
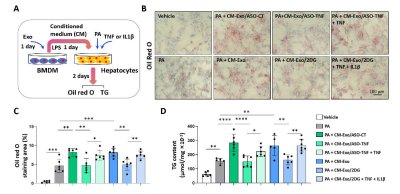
Redox Biology(IF/10.7):棕榈酸诱导AML12肝细胞脂质堆积模拟NASH脂毒性微环境
实验采用骨髓来源巨噬细胞(BMDMs)和RAW264.7巨噬细胞,通过脂多糖(LPS)刺激模拟炎症状态,评估外泌体递送ASO-TNF或2DG对TNF/IL1β表达的抑制作用(qRT-PCR、Western blot)。AML12肝细胞与巨噬细胞条件培养基共培养,结合棕榈酸(PA)诱导脂质堆积,通过油红O染色和甘油三酯检测分析脂质代谢变化。此外,通过siRNA敲低Sod1验证其在脂质积累中的调控作用。
2025-05-16
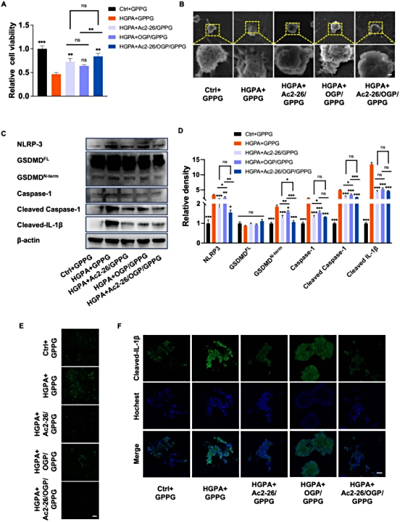
Biofabrication(IF/8.2):高糖/棕榈酸(HGPA)模拟体外糖尿病炎症环境并诱导巨噬细胞焦亡
棕榈酸(PA)作为饱和脂肪酸,在实验中用于模拟糖尿病相关的脂毒性应激,激活NLRP3炎症小体并诱导巨噬细胞焦亡。细胞处理中,THP-1细胞经PMA分化为M0巨噬细胞后,暴露于高糖(25.5mM)和PA(200μM)环境,通过CCK-8筛选出PA最佳浓度(图1B),并联合LPS构建炎症模型。MC3T3-E1成骨细胞在HGPA(300μMPA)中培养,通过ALP染色、qPCR和Westernblot评估成骨抑制及OGP的修复作用。实验表明,PA通过脂毒性加剧炎症和氧化应激,而Ac2-26/OGP/GPPG可靶向调控此过程。
2025-04-29
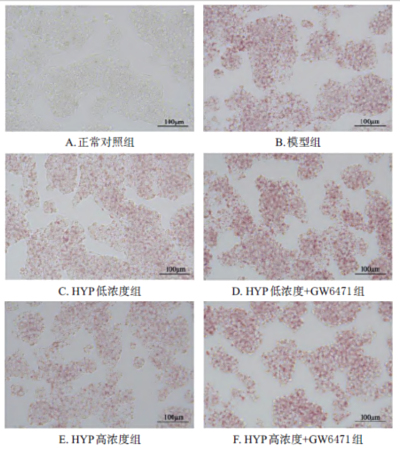
建立高脂细胞模型研究金丝桃苷对HepG2肝细胞的保护机制
具体采用HepG2细胞通过油酸(钠)(400 mmol/L)和棕榈酸(钠)(200 mmol/L)诱导脂滴沉积24小时,模拟NAFLD病理状态。设置正常对照组、模型组、HYP低/高浓度组及HYP+GW6471干预组,通过油红O染色观察脂滴蓄积,并检测(甘油三酯)TAG含量。结果显示,HYP显著减少脂滴面积和TAG水平,而GW6471可逆转此效应,证实PPARα是HYP调控脂质代谢的核心靶点。
2025-04-17
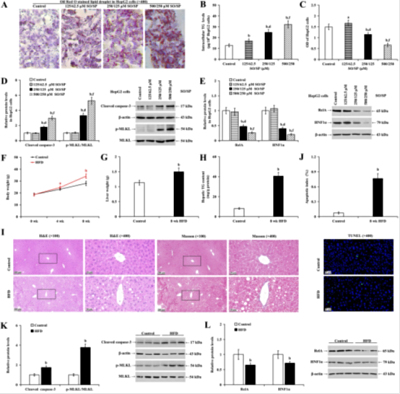
Cell Death Discovery(IF/6.1):高脂细胞添加剂诱导肝细胞建立脂肪变性模型(脂质沉积与细胞损伤)
本研究通过油酸钠(SO)和棕榈酸钠(SP)联合处理肝细胞系(HepG2/LO2),证实其以浓度梯度(125/62.5-500/250μM)诱导脂滴积累、甘油三酯(TG)含量显著升高,并抑制RelA/HNF1α互作,破坏脂代谢稳态。SO/SP激活凋亡(cleaved caspase-3)和坏死性凋亡(p-MLKL),而抑制剂Necrostatin-1和Z-VAD可分别缓解脂毒性和细胞死亡。脂质组学显示长链TG和鞘脂类(Cer/SPH)积累,伴随线粒体功能受损(ETC活性下降50%)、氧化应激(MDA升高2倍)及ER应激标志物(ATF4/GRP78)下调。RelA敲除加剧脂代谢紊乱,而过表达则显著改善表型。
2025-04-02
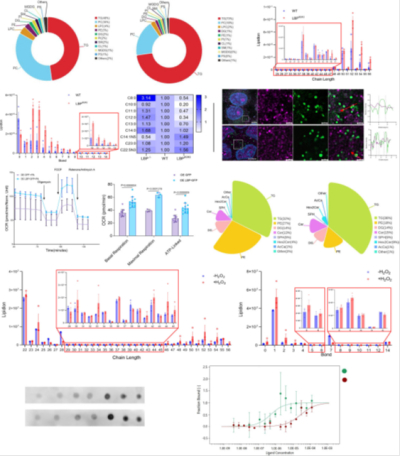
Nature Communications(2024/IF=14.7):LBP调控(HepG2细胞、小鼠原代肝细胞)氧化应激下脂滴稳态并诱导脂肪肝机制研究
本文阐明LBP在氧化应激下调控脂滴稳态的分子机制及其诱导脂肪肝的病理关联。 具体采用如下技术路线:①通过肝组织转录组和脂滴蛋白质组学筛选关键分子;②构建LBP敲除(LBP−/−)和过表达(LBPKI/KI)小鼠模型,结合HepG2细胞验证功能;③利用脂质组学、免疫共沉淀及AlphaFold结构预测解析LBP的脂质捕获活性;④探索抗氧化剂(NAC)和PRDX4互作对脂滴稳态的调控,验证治疗策略。
2025-03-24
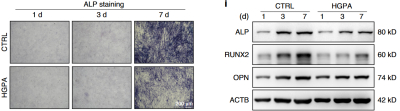
Bone Research(2025/IF=14.3):高糖高脂模拟糖尿病微环境处理MC3T3-E1成骨细胞建立细胞高脂损伤模型
本研究采用25.5 mM葡萄糖联合200 μM棕榈酸(钠)处理MC3T3-E1细胞及原代成骨细胞,模拟糖尿病微环境。处理持续7天(ALP染色评估分化)和21天(ARS染色检测矿化),结果显示高糖高脂显著抑制成骨标志物(RUNX2、COL1A1)表达,并降低线粒体膜电位(JC-1探针)、升高ROS(DCFH-DA/MitoSox染色),同时抑制PINK1/PRKN通路及LC3-II表达,导致线粒体自噬受损
2025-03-10
资讯中心
服务热线
15229257682


关注公众号
联系我们
· 网站导航
· 联系方式
网站首页
案例展示
技术分享
联系我们
Copyright © 版权所有 西安鲲创科技发展有限公司
关于我们
产品中心
联系电话:15229257682
联系邮箱:Ewallcage@163.com
公司地址:陕西省西安市碑林区友谊东路334号