Redox Biology(IF/10.7):棕榈酸诱导AML12肝细胞脂质堆积模拟NASH脂毒性微环境
在体外细胞实验中,使用200μM的棕榈酸(PA)、48h诱导AML12肝细胞脂质堆积,以模拟NASH的脂毒性微环境
实验采用骨髓来源巨噬细胞(BMDMs)和RAW264.7巨噬细胞,通过脂多糖(LPS)刺激模拟炎症状态,评估外泌体递送ASO-TNF或2DG对TNF/IL1β表达的抑制作用(qRT-PCR、Western blot)。AML12肝细胞与巨噬细胞条件培养基共培养,结合棕榈酸(PA)诱导脂质堆积,通过油红O染色和甘油三酯检测分析脂质代谢变化。此外,通过siRNA敲低Sod1验证其在脂质积累中的调控作用。
Redox Biology(IF/10.7):棕榈酸诱导AML12肝细胞脂质堆积模拟NASH脂毒性微环境
1. 前言
非酒精性脂肪性肝炎(NASH)是慢性肝病的重要形式,其核心病理机制包括肝脂肪堆积、炎症反应和纤维化。肝巨噬细胞分泌的促炎因子肿瘤坏死因子(TNF)和白介素1β(IL1β)在疾病进展中起关键作用。然而,系统性抑制这些因子的传统疗法常伴随副作用,亟需靶向递送策略。外泌体因其天然靶向肝脏巨噬细胞的特性及高生物相容性,成为理想的药物载体。本研究聚焦于通过外泌体递送TNF反义寡核苷酸(ASO-TNF)或糖酵解抑制剂2-脱氧-D-葡萄糖(2DG),靶向抑制巨噬细胞炎症因子表达,探索其治疗潜力及机制。
实验采用骨髓来源巨噬细胞(BMDMs)和RAW264.7巨噬细胞,通过脂多糖(LPS)刺激模拟炎症状态,评估外泌体递送ASO-TNF或2DG对TNF/IL1β表达的抑制作用(qRT-PCR、Western blot)。AML12肝细胞与巨噬细胞条件培养基共培养,结合棕榈酸(PA)诱导脂质堆积,通过油红O染色和甘油三酯检测分析脂质代谢变化。此外,通过siRNA敲低Sod1验证其在脂质积累中的调控作用。
2.高脂细胞添加剂
文中采用棕榈酸(Palmitic Acid)作为高脂细胞添加剂(货号KC003,Kunchuang Science and Technology Development, 鲲创科技发展)作为游离脂肪酸(free fatty acids,FFAs)处理细胞。

针对AML12肝细胞,部分研究人员会单独使用棕榈酸(钠)或油酸(钠)进行诱导,由于肝细胞本身较为敏感,某些情况下单独使用其中一种脂肪酸也能获得理想的实验结果。然而,从机制上讲,棕榈酸(钠)主要诱导细胞损伤和炎症反应,而油酸(钠)主要促进细胞脂质沉积。因此,在研究非酒精性脂肪性肝病(NAFLD)时,更推荐采用棕榈酸(钠)与油酸(钠)联合诱导的技术方案,不仅能更好地模拟人体内的病理生理环境,还能提高实验结果的可靠性和科学性。推荐油酸高脂试剂盒(KC006),该试剂盒包括了棕榈酸(钠)、油酸(钠)和溶剂对照,能够直接使用,具备溶剂无毒、常温无析出,浓度准确,无需加热助溶等优点,显著减少操作步骤,提升实验的稳定性。
3.细胞处理及部分实验结果
研究首先通过分析公共数据库(如GSE167523和GSE119340)证实NASH患者和小鼠模型中TNF/IL1β显著上调,且主要来源于肝巨噬细胞(图1A-C)。体外实验中,BMDMs和RAW264.7细胞经LPS刺激后,2DG处理可同时抑制TNF和IL1β的mRNA及蛋白表达(图1D-F),而ASO-TNF特异性降低TNF水平(图1E-F),表明两种药物对炎症因子的选择性调控。外泌体载药后,透射电镜(图2C)和纳米颗粒追踪分析(图2B)显示其形态与尺寸未受显著影响,且标志蛋白Alix、Tsg101高表达(图2D),证明载药过程未破坏外泌体完整性。
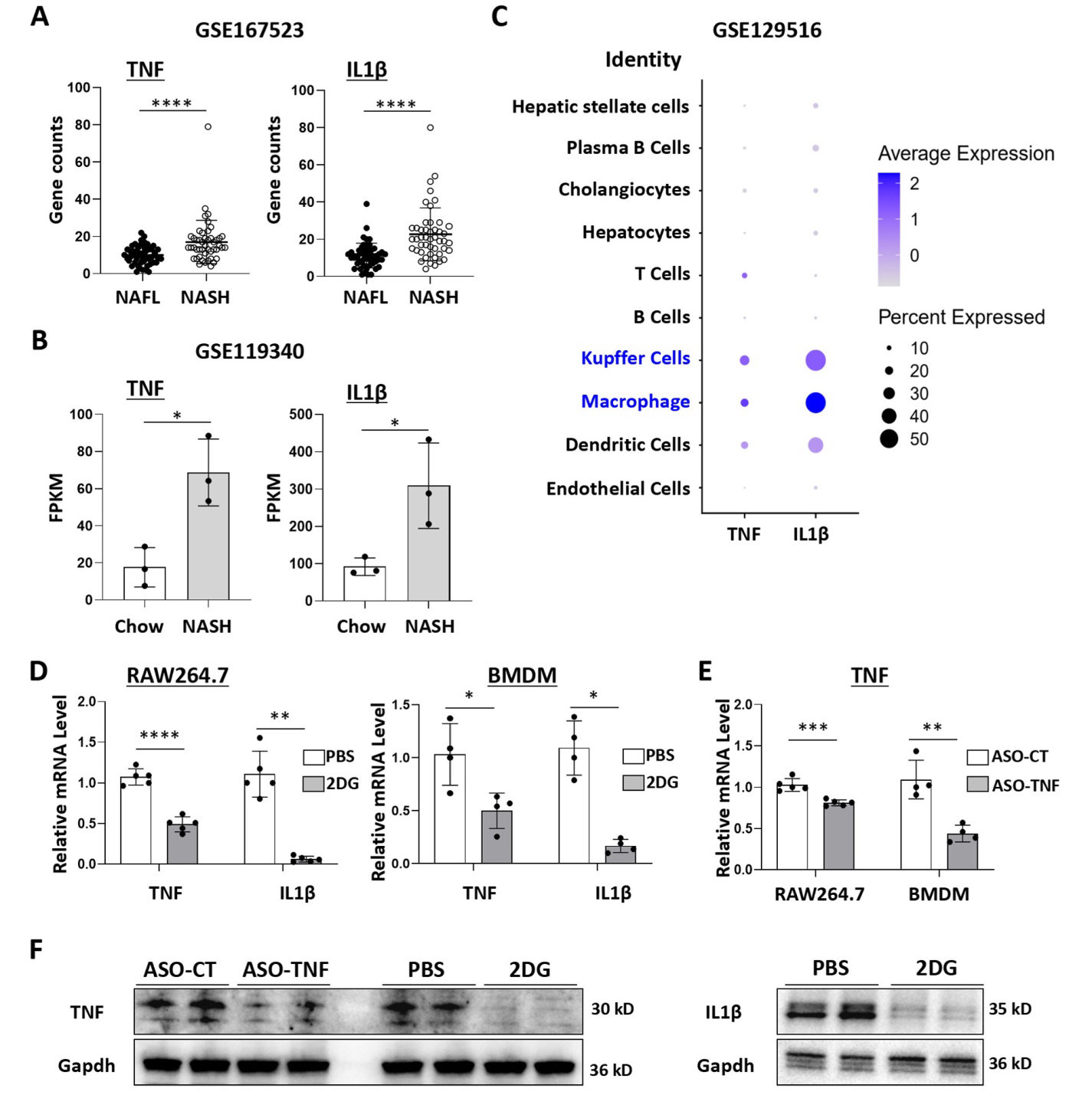
图1 ANXA1在糖尿病牙周炎中随巨噬细胞的增生而降低。2-脱氧-D-葡萄糖(2DG)或抗TNF反义寡核苷酸(ASO-TNF)可降低巨噬细胞TNF和/或IL-1β的表达。(A)基因表达综述(NAFLD患者,NAFL=51,NASH=47)中转录组数据集GSE167523的人肝脏中TNF和IL1β的表达分析。(B)来自转录组数据集GSE119340的喂食饲料和NASH诱导小鼠肝脏中TNF和IL1β表达的分析。(C)使用scRNAseq数据集GSE129516进行点图分析,以评估肝细胞群中TNF和IL1β的表达水平。(D)RAW264.7细胞或骨髓基质细胞用2DG(2mM)和脂多糖(LPS,200ngmL−1)处理24h,并使用qRT-PCR检测TNF和IL1β的表达。(E)用ASO-TNF(100nM)转染RAW264.7细胞或BMDM18-24小时,然后用LPS刺激24小时,并使用qRT-PCR测定TNF的表达。(F)用2DG或ASO-TNF处理RAW264.7细胞,以Gapdh为对照,Westernblot检测TNF和/或IL-1β的表达。
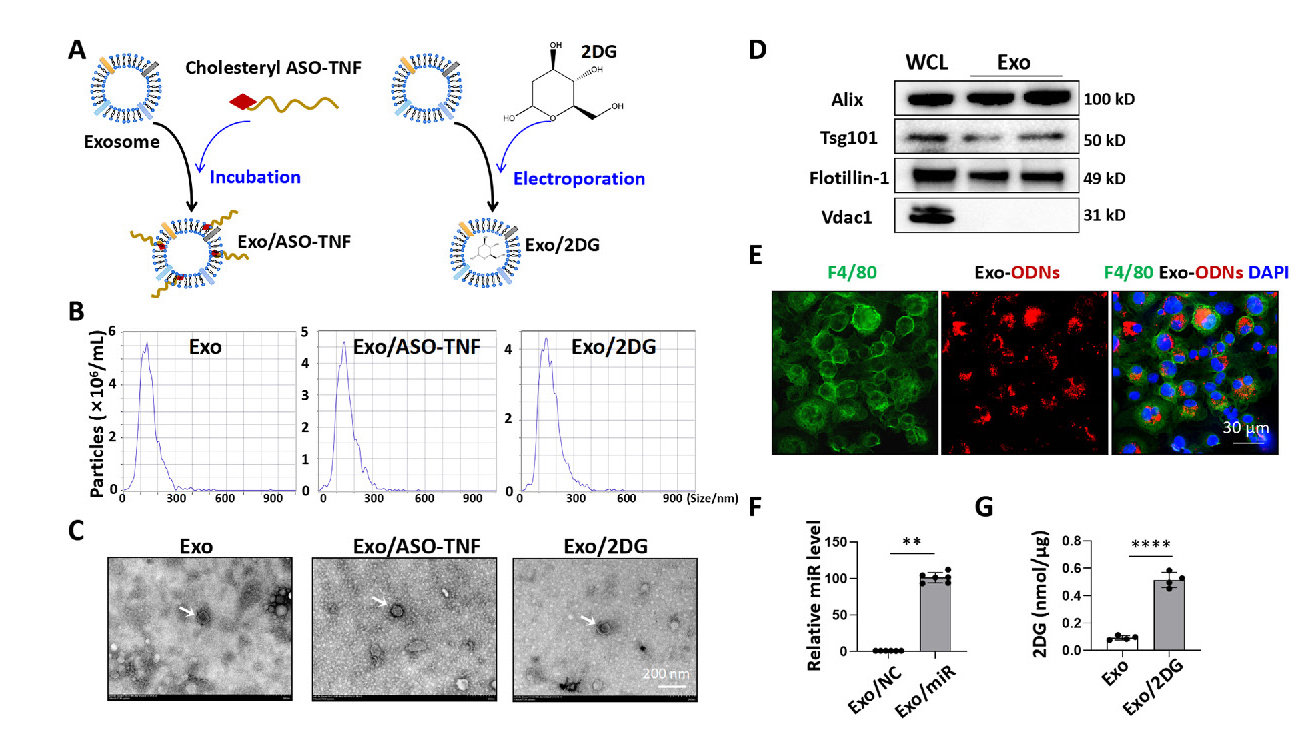
图2 ASO-TNF或2DG可负载exosome。(A)负载ASO-TNF或2DG的外来体示意图。(B)通过纳米颗粒示踪分析(NTA)测定bEnd.3衍生的外来体的大小分布。(C)用透射电镜(TEM)观察外源体的形态。(D)Western blot检测bEnd.3细胞裂解液和exosome中阿利克斯、Tsg 101、Flotillin-1和Vdac 1的表达水平。(E)将BMDM与载有德克萨斯红标记和胆固醇修饰的寡核苷酸的外来体(1 μg外来体/10 pmol ODNs)一起孵育。12小时后,用抗小鼠F4/80抗体对BMDM进行染色,并通过荧光显微镜进行分析。细胞核用DAPI复染。(F)将胆固醇修饰的乱序miRNA(NC)或miR-188- 5 p模拟物(miR)与exosomes孵育,并通过qRT-PCR检测exosomes中miR-188- 5 p的水平,以U6作为参考对照。(G)用电穿孔法将2DG(0.6M 2DG VS 100 μg exosomes)负载到exosomes中,用葡萄糖氧化酶法测定exosomes中2DG的浓度。
进一步实验显示,负载Texas红标记ODN的外泌体可高效递送至巨噬细胞(图2E),而电穿孔载入的2DG浓度达400pmol/μg(图2G)。体外共培养中,Exo/ASO-TNF或Exo/2DG显著降低LPS刺激后巨噬细胞的TNF/IL1β表达(图3A-C),且Exo/2DG促进M2极化标志物Arg1和IL10上调(图S2B)。通过条件培养基(CM)转移实验,发现经Exo/ASO-TNF或Exo/2DG处理的巨噬细胞CM可减少AML12肝细胞中PA诱导的脂滴积累(图4B-D),而外源性添加TNF/IL1β部分逆转此效应,证实炎症因子直接驱动脂质沉积。
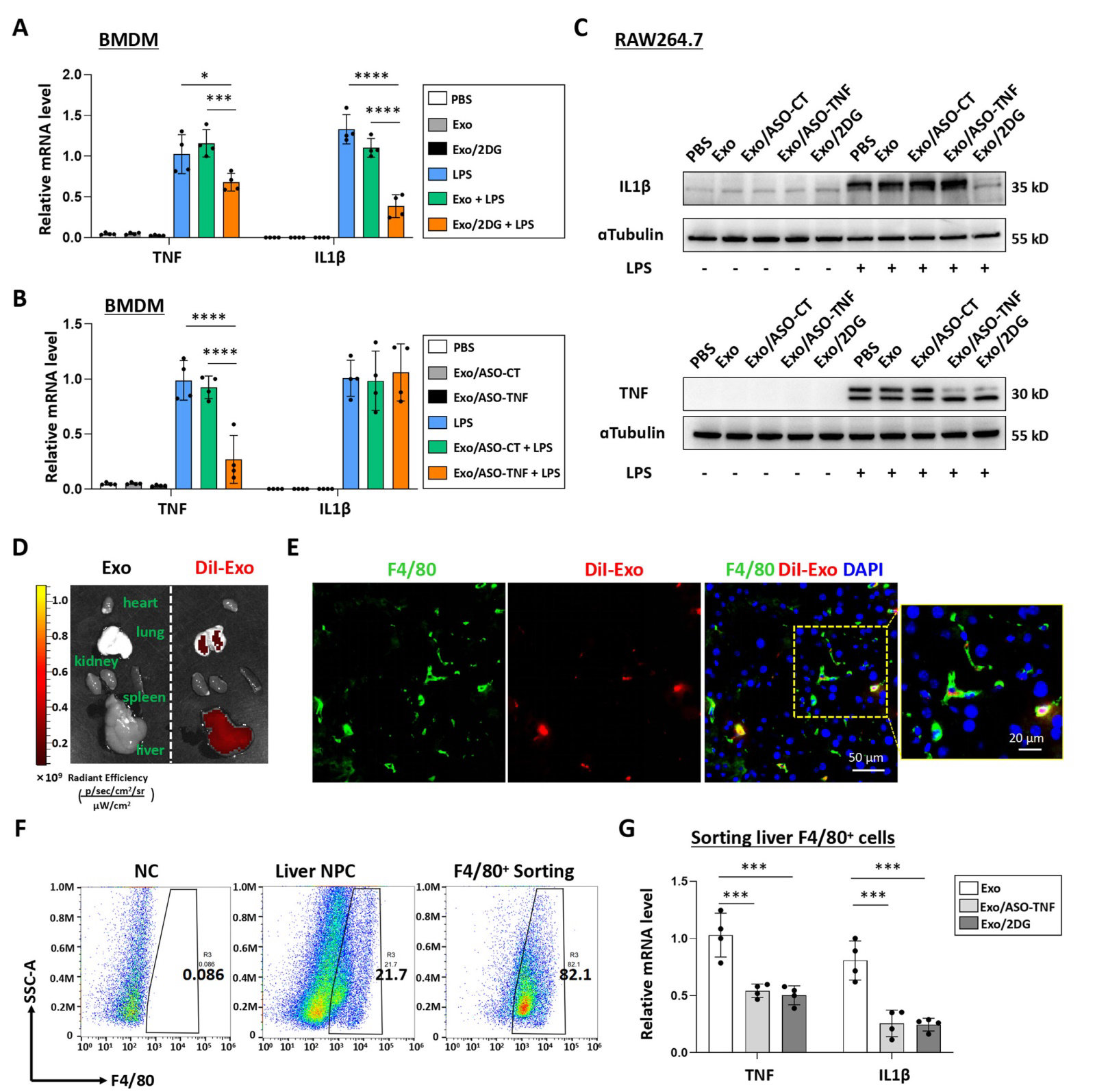
图3 Exo/ASO-TNF或Exo/2DG在体内外均能抑制巨噬细胞TNF和/或IL 1 β的表达。(A-B)将BMDM与Exo、Exo/2DG、Exo/ASO-Control(Exo/ASO-CT)或Exo/ASO-TNF孵育24 h,然后更换并与含有LPS(200 ng mL−1)的新鲜培养基一起再培养24 h,并通过qRT-PCR检测TNF和IL 1 β的表达。(C)将RAW264.7巨噬细胞与Exo、Exo/2DG、Exo/ASO-CT或Exo/ASO-TNF共同孵育24 h,然后用LPS(200 ng mL−1)处理24 h,通过Western blot检测TNF和IL 1 β的表达,以微管蛋白作为参考对照。(D)将DiI标记的外泌体(200 μg)通过尾静脉注射到喂食MCD的小鼠中。6 h后,使用生物发光成像检查肝、肺、脾、肾和心脏中的DiI信号。(E)用抗小鼠F4/80抗体染色肝切片,并通过荧光显微镜进行分析。细胞核用DAPI复染。(F)用MCD饲料喂养小鼠4周,并在最后2周通过尾静脉向小鼠注射Exo/ASO-TNF或Exo/2DG(200 μg)4次。使用磁激活细胞分选(MACS)分离F4/80+肝巨噬细胞。流式细胞仪检测F4/80+细胞纯度。(G)通过qRT-PCR测量F4/80+肝巨噬细胞中TNF和IL 1 β的mRNA水平。
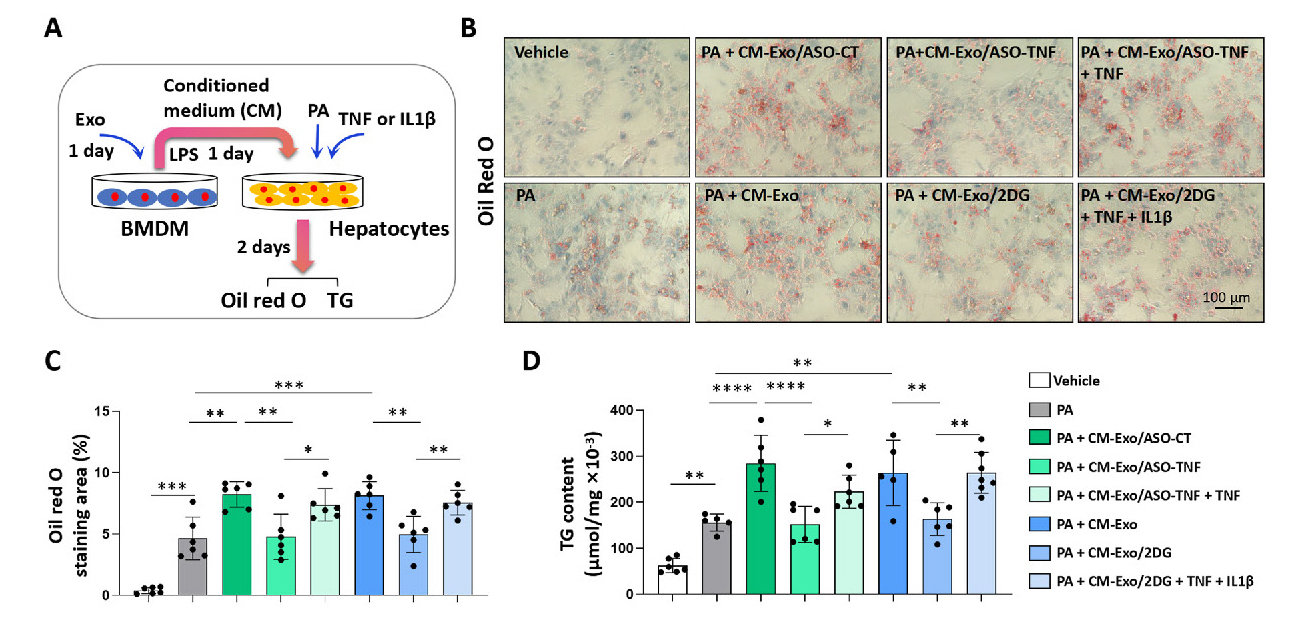
图4 Exo/ASO-TNF或Exo/2DG在体外减弱原代肝细胞中的脂质蓄积。(A)示意图显示BMDM用Exo/ASO-TNF或Exo/2DG处理1天,更换并用含有LPS的新鲜培养基培养1天,并收获条件培养基(CM)。然后,在存在或不存在TNF(10ngmL−1)和/或IL1β(10ngmL−1)的棕榈酸培养基(PA,200μM)中,将原代小鼠肝细胞与CM一起培养2天。(B)使用油红O染色评估原代肝细胞中的脂质蓄积。(C)对(B)组油红O染色阳性面积进行定量比较。
机制层面,RNA测序显示Exo/ASO-TNF或Exo/2DG处理后肝组织氧化磷酸化通路激活,炎症通路抑制。Sod1作为关键抗氧化酶,其表达在治疗组显著上调,且敲低Sod1可抵消外泌体对脂质积累的改善作用。此外,TNF通过激活JNK通路抑制Sod1表达,而外泌体治疗降低肝组织pJNK水平,揭示其通过抑制JNK-Sod1轴调控氧化应激与脂代谢。
4.总结
炎症介质肿瘤坏死因子(TNF)和白细胞介素1 β(IL 1 β)主要来源于肝脏中的肝巨噬细胞,在非酒精性脂肪性肝炎(NASH)的进展中起着至关重要的作用。同时,静脉注射的外泌体主要分布在肝脏中,并且主要被肝巨噬细胞摄取。在此,旨在评估通过外泌体靶向抑制肝巨噬细胞中TNF和IL 1 β表达作为NASH潜在治疗策略的可行性。本研究证明,TNF反义寡核苷酸(ASO-TNF)或2-脱氧-D-葡萄糖(2DG)能有效抑制巨噬细胞TNF和/或IL 1 β的表达。ASO-TNF或2DG负载的Exosomes在体内外均能抑制巨噬细胞TNF和/或IL 1 β的表达。此外,输注Exo/ASO-TNF或Exo/2DG显著减轻了胆碱缺乏氨基酸定义(CDAA)或蛋氨酸和胆碱缺乏(MCD)饮食喂养小鼠的实验性脂肪性肝炎。RNA-seq结果显示,用Exo/ASO-TNF或Exo/2DG处理显著抑制促炎信号通路。机制上,我们观察到给予Exo/ASO-TNF或Exo/2DG可以通过上调超氧化物歧化酶1(Sod 1)的表达来减弱NASH进展。总之,研究结果表明,输注载有ASO-TNF或2DG的外泌体减轻了小鼠模型中的实验性脂肪性肝炎。因此,输注载有抗炎剂的外来体有望成为NASH治疗的潜在治疗策略。
小编有话说:
在体外细胞实验中,使用200μM的棕榈酸(PA)、48h诱导AML12肝细胞脂质堆积,以模拟NASH的脂毒性微环境。外泌体递送ASO-TNF或2DG通过抑制巨噬细胞炎症因子分泌,间接减少肝细胞脂滴形成,且这一效应依赖于Sod1介导的抗氧化机制。实验中的细胞处理涵盖巨噬细胞炎症调控、肝细胞脂质代谢分析及基因敲低验证,凸显外泌体靶向递送在多细胞交互中的核心作用。高脂细胞添加剂(Kunchuang Science and Technology)在NASH模型中不可或缺,其稳定性为疾病机制研究提供可靠工具。未来,结合外泌体的精准递送系统与优质脂质诱导试剂,有望加速抗NASH药物的开发与转化,为肝病治疗开辟新路径。
参考文献
He,F. , Du,W. , Liu,Y. ,et al.J. Exosome-equipped TNF antisense oligodeoxynucleotide or 2-deoxy-D-glucose ameliorated nonalcoholic steatohepatitis by modulating superoxide dismutase 1 in mice.Redox Biology, 2025. https://doi.org/10.1016/j.redox.2025.103488



