建立高脂细胞模型研究金丝桃苷对HepG2肝细胞的保护机制
具体采用HepG2细胞通过油酸(钠)(400 mmol/L)和棕榈酸(钠)(200 mmol/L)诱导脂滴沉积24小时,模拟NAFLD病理状态
具体采用HepG2细胞通过油酸(钠)(400 mmol/L)和棕榈酸(钠)(200 mmol/L)诱导脂滴沉积24小时,模拟NAFLD病理状态。设置正常对照组、模型组、HYP低/高浓度组及HYP+GW6471干预组,通过油红O染色观察脂滴蓄积,并检测(甘油三酯)TAG含量。结果显示,HYP显著减少脂滴面积和TAG水平,而GW6471可逆转此效应,证实PPARα是HYP调控脂质代谢的核心靶点。
建立高脂细胞模型研究金丝桃苷对HepG2肝细胞的保护机制
中国药房(中文核心/2025)
1. 前言
非酒精性脂肪性肝病(NAFLD)以肝脏甘油三酯(TAG)过度沉积为核心特征,与代谢综合征密切相关,但现有治疗药物存在局限性。金丝桃苷(hyperoside,HYP),又名槲皮素-3-O-β-D- 吡喃半乳糖苷,是一种黄酮类化合物,具有抗炎、抗氧化及潜在调控脂质代谢的作用。PPARα是脂质代谢的关键靶点,但其在NAFLD中的作用机制尚需深入探究。本研究结合脂质组学技术,聚焦HYP通过PPARα通路调控脂质合成的分子机制,为天然药物治疗NAFLD提供理论依据。
作者通过高脂饲料诱导小鼠NAFLD模型,评估HYP对肝脏脂质堆积、血清生化指标及病理形态的影响,并利用LC-MS/MS进行脂质组学分析。同时,在HepG2细胞中建立油酸/棕榈酸诱导的高脂细胞模型,结合PPARα抑制剂GW6471,验证HYP通过激活PPARα减少脂滴蓄积的机制。动物与细胞实验相结合,全面解析HYP的作用靶点及通路。
其中,具体采用HepG2细胞通过油酸(钠)(400 mmol/L)和棕榈酸(钠)(200 mmol/L)诱导脂滴沉积24小时,模拟NAFLD病理状态。设置正常对照组、模型组、HYP低/高浓度组及HYP+GW6471干预组,通过油红O染色观察脂滴蓄积,并检测(甘油三酯)TAG含量。结果显示,HYP显著减少脂滴面积和TAG水平,而GW6471可逆转此效应,证实PPARα是HYP调控脂质代谢的核心靶点。
2. 高脂细胞添加剂
文中实验用高脂细胞添加剂采用油酸(钠)/棕榈酸(钠)(货号KC006,西安鲲创科技发展有限公司)处理HepG2细胞24小时。

该试剂盒包括了独立包装的油酸(钠)、棕榈酸(钠)和溶剂对照,能够直接使用,具备溶剂无毒、常温无析出,无需多次加热助溶等优点,显著减少操作步骤,提升实验的稳定性。
3.细胞处理方法
1)细胞培养
将HepG2细胞接种于含10%胎牛血清、1%青霉素-链霉素双抗的DMEM培养基中,于37℃、5%CO2的条件下培养。
2)金丝桃苷(HYP)干预浓度筛选
采用CCK-8法检测细胞活力。取HepG2细胞,以5000个/孔接种到96孔板中,用0、10、100、1000μmol/L的HYP干预,并设置含细胞、不含药物的阴性对照组,不含细胞和药物的空白对照组。处理24h后,每孔加入不含血清的DMEM培养基180μL和CCK-8试剂20μL,于37℃下避光孵育2h,使用酶标仪在450nm波长下检测每孔的吸光度(A)值,并计算细胞活力。
3)细胞脂滴蓄积情况和TAG含量检测
将HepG2细胞分为正常对照组、模型组、HYP低浓度(50μmol/L)组、HYP高浓度(100μmol/L)组、HYP低浓度+GW6471组、HYP高浓度+GW6471组,每组3个复孔。除正常对照组外,其他各组细胞均采用400mmol/L的油酸和200mmol/L的棕榈酸诱导24h模拟肝脂质沉积;此外,HYP低、高浓度组细胞分别用50、100μmol/L的HYP干预24h;HYP低浓度+GW6471组和HYP高浓度+GW6471组细胞在使用50、100μmol/L的HYP干预前先用10mmol/L的GW6471干预24h。随后,按相应试剂盒说明书方法进行操作:经油红O染色后使用显微镜观察细胞内的脂滴蓄积情况,用ImageJ软件分析单位面积内的脂滴,并计算相对脂滴面积占比;检测细胞内TAG含量。
4.实验结果
在验证HYP调控PPARα的机制研究中,HepG2细胞被油酸和棕榈酸诱导为高脂模型(图1A,模型组),脂滴蓄积显著增加(脂滴面积占比23.43% vs. 正常对照组1.90%)。通过油红O染色可见,模型组细胞中脂滴呈密集红色颗粒(图1B),而HYP低、高浓度组(50μmol/L和100 μmol/L)的脂滴面积分别降至8.15%和8.93%(表1),染色强度明显减弱(图1C、D),表明HYP剂量依赖性地抑制脂质沉积。 为进一步验证PPARα的介导作用,研究引入抑制剂GW6471。如图1E、F所示,HYP低浓度+GW6471组的脂滴面积反弹至26.60%,接近模型组水平,TAG含量亦回升至0.54 mmol/g prot(表1)。这一逆转效应证实,HYP通过激活PPARα抑制脂质合成,而阻断PPARα后,HYP的改善作用被显著削弱。 脂质代谢相关指标显示,HYP高浓度组TAG含量(0.37 mmol/g prot)较模型组(0.54 mmol/g prot)下降34.3%(表1),且GW6471干预后TAG含量恢复至0.51 mmol/g prot,进一步支持PPARα的核心调控地位。上述结果通过显微图像与定量数据的结合,直观呈现了HYP通过PPARα通路减轻肝细胞脂毒性的分子机制。
表1各组细胞中相对脂滴面积占比和TAG含量比较(x±s,n=3)
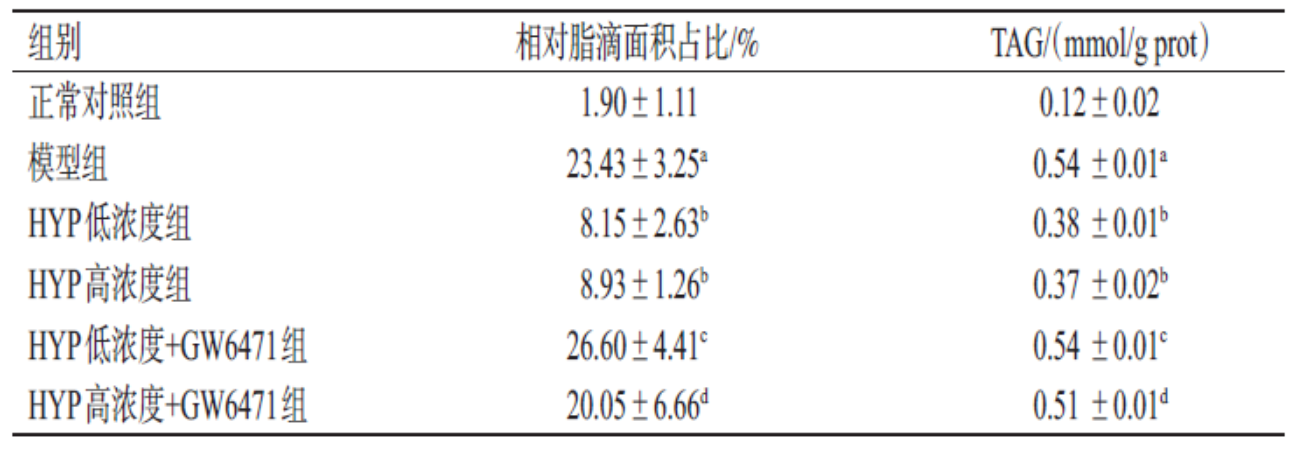
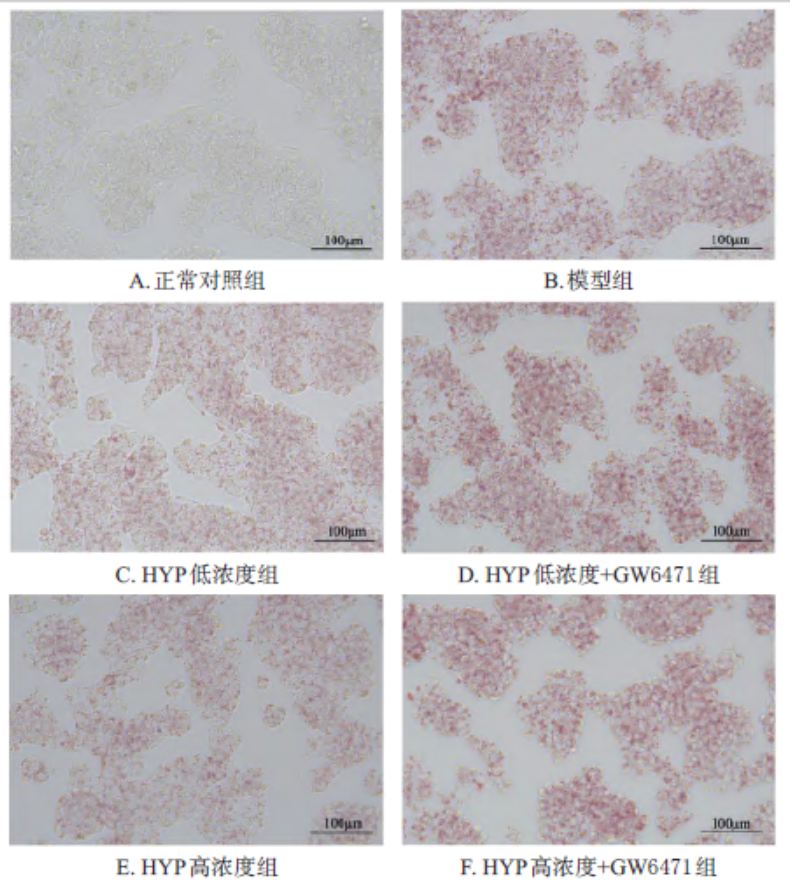
图1各组细胞中脂滴蓄积的显微图(油红O染色)
5.讨论
NAFLD是全球最常见的慢性肝病,其特征是肝脏中TAG蓄积过多,并与肥胖、胰岛素抵抗、血脂异常和炎性疾病相关。NAFLD的发病机制复杂,脂质代谢在NAFLD病理过程中发挥了重要作用,具有调节脂质代谢和肝保护作用的中医药成分在NAFLD治疗中具有独特的效果。其中,HYP能够减少氧化应激和炎症反应,在体外和体内研究中均显示出对肝细胞的保护作用,能减少肝细胞的凋亡和坏死,抑制肝纤维化的进程,在多种肝脏疾病模型中均显示出治疗潜力。
为了验证HYP是否通过调控PPARα介导NAFLD小鼠肝脏脂质合成途径从而发挥改善NAFLD的作用,本研究利用HepG2细胞进行了研究。结果发现,与正常对照组比较,模型组细胞中脂滴蓄积和TAG含量均显著增加;与模型组比较,HYP低、高浓度组细胞中脂滴蓄积和TAG含量均显著减少;而PPARα抑制剂GW6471能显著逆转HYP对上述指标的改善作用,表明PPARα是HYP改善NAFLD的关键靶点。
小编有话说:
本研究采用油酸(钠)和棕榈酸(钠)复合诱导的HepG2细胞模型,成功模拟了NAFLD的脂质蓄积表型,为药物机制研究提供了可靠细胞模型。实验证实,HYP通过激活PPARα显著降低脂滴和TAG水平,而GW6471的逆转效应进一步强化了这一结论。高脂细胞添加剂由西安鲲创科技提供,其精准配比与高稳定性为细胞模型的构建奠定基础。未来,该试剂可广泛应用于代谢性疾病研究,助力天然药物开发与精准医疗的推进,也为肝脏疾病机制探索及治疗策略优化提供坚实技术保障。
参考文献
龙昌锐,乡世健等. 金丝桃苷调控肝脏脂质合成改善小鼠非酒精性脂肪性肝病的机制研究 [J], 中国药房, 2025.



