Bone Research(2025/IF=14.3):高糖高脂模拟糖尿病微环境处理MC3T3-E1成骨细胞建立细胞高脂损伤模型
使用高糖高脂(HGPA)条件模拟糖尿病微环境,发现高糖高脂处理的MC3T3-E1成骨细胞分化和矿化能力显著下降,线粒体膜电位降低、活性氧(ROS)积累,且PINK1、PRKN等自噬相关蛋白表达减少。
本研究采用25.5 mM葡萄糖联合200 μM棕榈酸(钠)处理MC3T3-E1细胞及原代成骨细胞,模拟糖尿病微环境。处理持续7天(ALP染色评估分化)和21天(ARS染色检测矿化),结果显示高糖高脂显著抑制成骨标志物(RUNX2、COL1A1)表达,并降低线粒体膜电位(JC-1探针)、升高ROS(DCFH-DA/MitoSox染色),同时抑制PINK1/PRKN通路及LC3-II表达,导致线粒体自噬受损
Bone Research(2025/IF=14.3):高糖高脂模拟糖尿病微环境处理MC3T3-E1成骨细胞建立细胞高脂损伤模型
1. 前言
2型糖尿病(T2DM)是一种以胰岛素抵抗和β细胞功能减退为特征的常见代谢性疾病,其全球患病率持续上升,造成巨大的医疗和经济负担。最新研究发现,T2DM患者存在骨微结构破坏现象,部分归因于成骨细胞功能受损。尽管T2DM患者脆性骨折风险增加,但导致成骨细胞功能障碍的确切分子机制仍有待阐明,这阻碍了糖尿病性骨质疏松治疗策略的研究。
骨质疏松症线粒体在细胞内环境稳态中起着至关重要的作用,线粒体损伤与广泛的病理学相关。新的证据表明,线粒体功能障碍在糖尿病及其并发症(如糖尿病性骨质疏松症)的发生发展中处于中心阶段。持续的线粒体损伤导致活性氧(ROS)的积累,导致细胞稳态紊乱。在负责调节线粒体质量的机制中,有丝分裂吞噬(一种选择性自噬形式)是通过清除受损线粒体来维持细胞健康的关键过程。PTEN诱导的激酶1(PINK1)-E3泛素-蛋白连接酶parkin(PRKN)通路已被确定为启动有丝分裂吞噬的信号通路,其中PINK1在线粒体去极化时积聚在线粒体外膜上,随后募集并激活PRKN和自噬受体以去除受损线粒体。最近的研究已经证明PINK1在成骨细胞分化中的重要作用,并强调了增强成骨细胞有丝分裂吞噬以解决年龄相关性骨质疏松症的治疗潜力。
本文作者使用高糖高脂(HGPA)条件模拟糖尿病微环境,发现高糖高脂处理的MC3T3-E1成骨细胞分化和矿化能力显著下降,线粒体膜电位降低、活性氧(ROS)积累,且PINK1、PRKN等自噬相关蛋白表达减少。通过SIRT3基因过表达(Lv-Sirt3)或药物激活(Honokiol),可逆转FOXO3乙酰化水平,恢复其核转位,促进PINK1/PRKN通路活化和线粒体自噬,从而改善成骨细胞功能。进一步实验表明,抑制线粒体自噬(如使用mdivi-1)会抵消SIRT3的修复作用,证实SIRT3通过调控线粒体自噬途径影响骨形成。
2.高糖高脂试剂盒
文中采用棕榈酸(Palmitic Acid)作为高脂细胞添加剂(货号KC003,Kunchuang Technology, 鲲创科技)作为游离脂肪酸(free fatty acids,FFAs)处理细胞。

此外,也可以直接使用高糖试剂盒(货号KT001,高糖高脂试剂盒 ),该试剂盒包括了葡萄糖、棕榈酸(钠)和溶剂对照,能够直接使用,具备溶剂无毒、常温无析出,无需多次加热助溶等优点,显著减少操作步骤,提升实验的稳定性。
3.细胞处理及部分实验结果
作者采用25.5 mM 葡萄糖联合200 μM 棕榈酸(palmitic acid)处理MC3T3-E1细胞,对成骨细胞诱导7天后进行ALP染色,可见高糖高脂显著降低了成骨细胞的骨形成(图1);对成骨诱导21天后,高糖高脂显著抑制了成骨细胞的矿化(图2)。
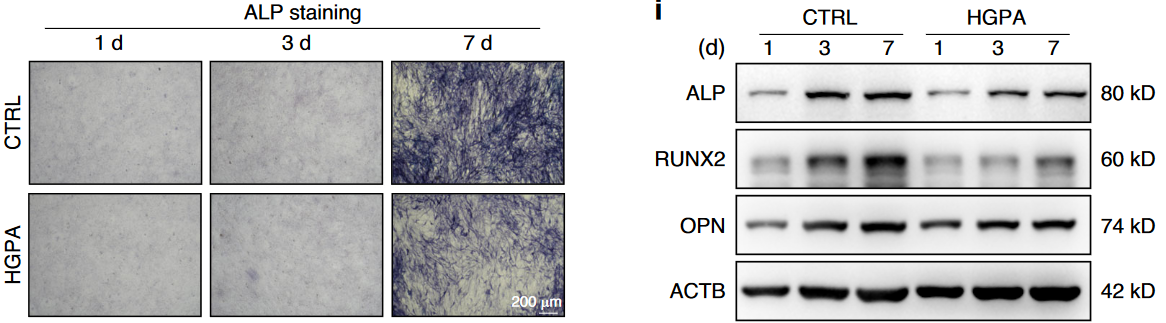
图1 高糖高脂显著降低了成骨细胞的骨形成
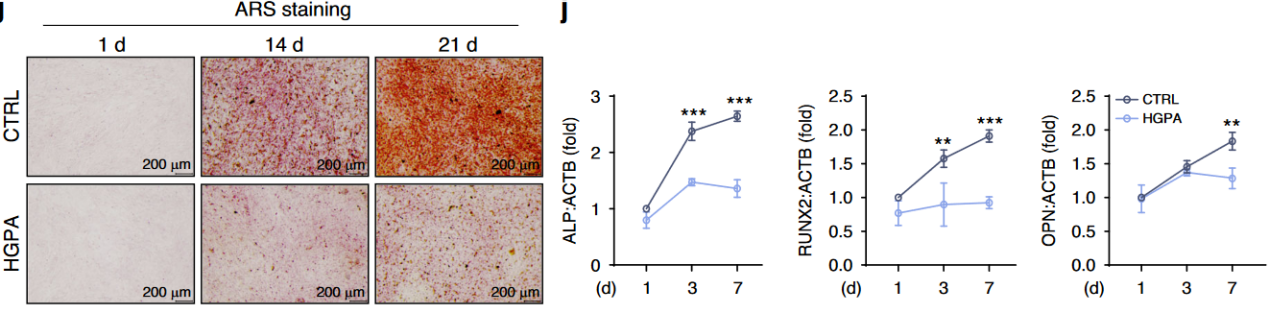
图2高糖高脂显著抑制了成骨细胞的矿化
接下来,作者进一步采用25.5 mM 葡萄糖+ 200 μM 棕榈酸(palmitic acid)处理成骨细胞48h,发现显著损伤了成骨细胞中的线粒体质量,导致成骨细胞线粒体发生大量的碎片化(图3)。
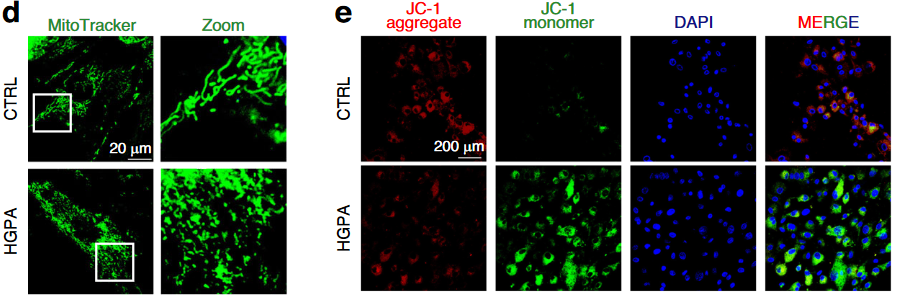
图3 高糖高脂显著损伤了成骨细胞中的线粒体质量
此外,还显示25.5 mM 葡萄糖+ 200 μM 棕榈酸(palmitic acid)导致了成骨细胞的线粒体自噬发生严重受损,降低了线粒体自噬的关键因子Pink1/Parkin的表达(图4)。
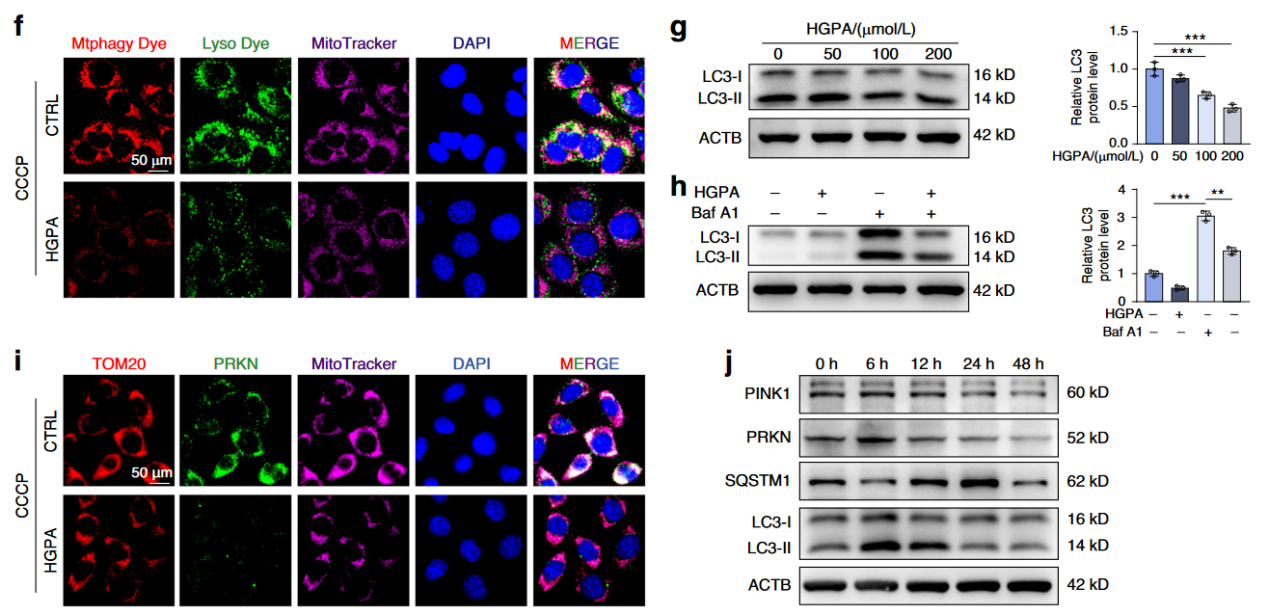
图4高糖高脂导致线粒体自噬发生严重受损
4.总结
该研究的细胞实验聚焦于探究T2DM微环境对成骨细胞功能的影响及SIRT3的调控机制。使用MC3T3-E1细胞和从HFD&STZ小鼠分离的原代成骨细胞,通过高糖(25.5 mM)和高脂(200 μM棕榈酸,HGPA)模拟糖尿病条件。结果显示,高糖高脂处理显著抑制细胞分化和矿化(ALP和ARS染色减弱),并降低成骨标志物(RUNX2、COL1A1)的表达。线粒体功能检测(JC-1探针)表明高糖高脂导致线粒体膜电位下降,同时ROS水平(DCFH-DA和MitoSox染色)升高。透射电镜和MitoTracker染色显示线粒体形态异常(碎片化、基质扩张)。
在机制方面,高糖高脂降低SIRT3表达,导致线粒体蛋白过度乙酰化,并抑制PINK1/PRKN通路及LC3-II表达,表明线粒体自噬受损。通过SIRT3过表达(Lv-Sirt3)或Honokiol处理可恢复FOXO3去乙酰化,促进其核转位,进而通过CUT&Tag实验证实FOXO3直接结合Prkn启动子,激活Prkn基因转录,修复线粒体自噬。免疫共沉淀和分子对接证实SIRT3与FOXO3直接互作。此外,抑制线粒体自噬(mdivi-1)可逆转SIRT3对成骨功能的改善作用,进一步验证其机制依赖性。这些结果在体外模型中系统阐明了SIRT3通过FOXO3/PINK1/PRKN轴调控Prkn转录,维持线粒体稳态,从而缓解糖尿病相关成骨障碍的分子路径。
小编有话说:
本研究采用25.5 mM葡萄糖联合200 μM棕榈酸(钠)处理MC3T3-E1细胞及原代成骨细胞,模拟糖尿病微环境。处理持续7天(ALP染色评估分化)和21天(ARS染色检测矿化),结果显示高糖高脂显著抑制成骨标志物(RUNX2、COL1A1)表达,并降低线粒体膜电位(JC-1探针)、升高ROS(DCFH-DA/MitoSox染色),同时抑制PINK1/PRKN通路及LC3-II表达,导致线粒体自噬受损。该模型为糖尿病骨质疏松机制研究提供可靠工具,未来可探索SIRT3激活剂(如Honokiol)的临床转化潜力,或结合靶向基因治疗(如AAV-Sirt3)优化干预策略,同时需进一步解析SIRT3/FOXO3轴调控线粒体稳态的分子细节。
参考文献
Yansi Xian, Bin Liu ,et al. Enhanced SIRT3 expression restores mitochondrial quality control mechanism to reverse osteogenic impairment in type 2 [J], Bone Research, 2025.



