Nature Communications(2024/IF=14.7):LBP调控(HepG2细胞、小鼠原代肝细胞)氧化应激下脂滴稳态并诱导脂肪肝机制研究
本文阐明LBP在氧化应激下调控脂滴稳态的分子机制及其诱导脂肪肝的病理关联。 具体采用如下技术路线:①通过肝组织转录组和脂滴蛋白质组学筛选关键分子;②构建LBP敲除(LBP−/−)和过表达(LBPKI/KI)小鼠模型,结合HepG2细胞验证功能;③利用脂质组学、免疫共沉淀及AlphaFold结构预测解析LBP的脂质捕获活性;④探索抗氧化剂(NAC)和PRDX4互作对脂滴稳态的调控,验证治疗策略。
Nature Communications(2024/IF=14.7):LBP调控(HepG2细胞、小鼠原代肝细胞)氧化应激下脂滴稳态并诱导脂肪肝机制研究
1. 前言
氧化应激导致的脂质过氧化是代谢相关脂肪肝病(MAFLD)的核心机制,其中脂滴(LDs)通过隔离易氧化的长链不饱和甘油三酯(UFA-TG)维持脂质稳态,但其分子调控途径尚不明确。既往研究聚焦于脂滴相关蛋白(如PAT家族)的储存功能,但LBP(脂多糖结合蛋白)在氧化应激下的作用未被揭示。LBP传统上被认为是炎症相关蛋白,但其在脂代谢中的角色存在争议:一方面,LBP敲除可缓解脂肪肝;另一方面,其抗氧化功能可能通过调控脂滴形成保护细胞。本研究发现,慢性应激(如饥饿、H2O2刺激)显著上调LBP表达并促使其定位于脂滴,但其具体作用机制及与代谢紊乱(如胰岛素抵抗、肥胖)的关联仍需系统解析。
本文阐明LBP在氧化应激下调控脂滴稳态的分子机制及其诱导脂肪肝的病理关联。 具体采用如下技术路线:①通过肝组织转录组和脂滴蛋白质组学筛选关键分子;②构建LBP敲除(LBP−/−)和过表达(LBPKI/KI)小鼠模型,结合HepG2细胞验证功能;③利用脂质组学、免疫共沉淀及AlphaFold结构预测解析LBP的脂质捕获活性;④探索抗氧化剂(NAC)和PRDX4互作对脂滴稳态的调控,验证治疗策略。
2.高脂细胞添加剂
LBP调控氧化应激下脂滴稳态并诱导脂肪肝机制研究(中国科学技术大学)、以及Lipopolysaccharide binding protein resists hepatic oxidative stress by regulating lipid droplet homeostasis(Nature Communications)中采用棕榈酸(钠)(Palmitic Acid)作为高脂细胞添加剂(货号KC001,Kunchuang Technology, 西安鲲创)作为游离脂肪酸(free fatty acids,FFAs)处理细胞。棕榈酸(钠)能够直接溶解在完全培养基中,具备溶剂无毒、浓度准确、常温无析出、可长期保存、无需多次加热助溶等优点,显著减少操作步骤,提升实验的稳定性。
3. HepG2细胞的氧化应激响应与LBP定位
1)氧化应激诱导LBP表达与脂滴定位(图1e, 1f)
在HepG2细胞中,饥饿、H₂O₂或热休克等氧化应激显著上调LBP的mRNA表达(图1e),并促使LBP定位于脂滴(LDs),与脂滴标志物PLIN2共定位(图1f)。 棕榈酸(PA)处理24小时未直接诱导LBP表达(图1d),但PA诱导的脂滴与LBP共定位较少(图3e),表明LBP更倾向结合长链不饱和甘油三酯(UFA-TG)。
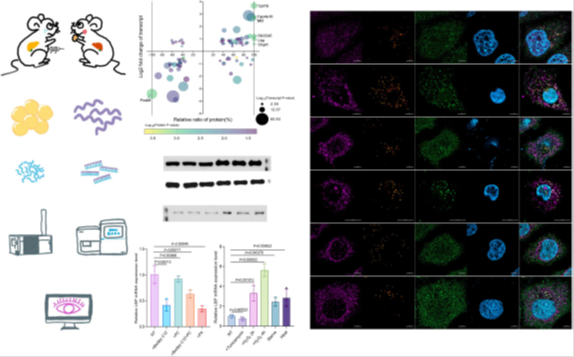
图1 氧化应激诱导LBP上调和LD易位
2)LBP过表达促进脂滴形成(图2d, 2e, 2f)
过表达LBP-GFP的HepG2细胞中,Bodipy C12标记的脂滴数量及体积显著增加(图2e, 2f)。 LBP敲除(LBP⁻/⁻)小鼠原代肝细胞几乎无脂滴形成,而LBP过表达(LBPᴷᴵ/ᴷᴵ)细胞脂滴显著增大(图2d)。
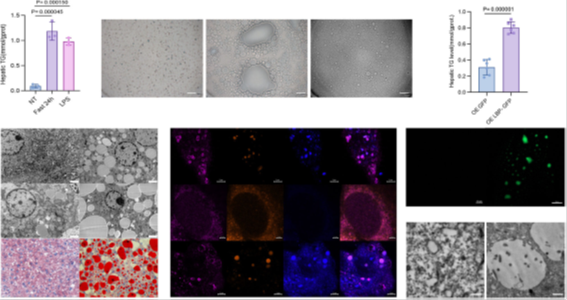
图2 LBP定位于LD驱动肝脂肪变性
4. PA代谢与LBP调控
1)PA的线粒体β-氧化增强(图3f,3g)
LBP过表达显著提高PA的线粒体β-氧化效率,氧气消耗率(OCR)增加(图3f,3g),而F436L突变体(LBP功能缺失)无此效应,表明LBP的脂质捕获活性依赖其结构完整性。PA代谢通过AMPK-ACC通路促进脂质合成,并激活JNK/NF-κB炎症通路(附图2e-g,2h-k)。
2)PA与UFA-TG的代谢差异
短链饱和脂肪酸(SCSFA,如PA)易分解为酰基辅酶A,通过线粒体快速供能,减少ROS生成(正文描述)。LBP通过隔离UFA-TG至脂滴,防止其过氧化,同时促进PA分解以满足能量需求(图3h-j)。
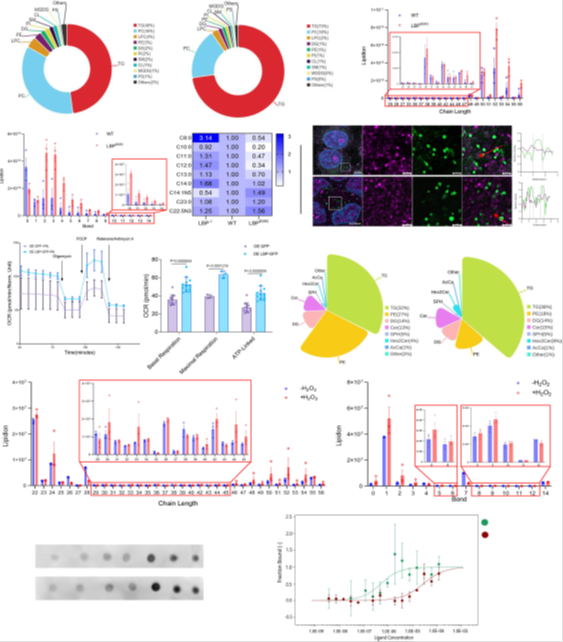
图3 LBP与不饱和TG结合以防止脂质过氧化
4.总结
该研究通过 HepG2细胞模型和小鼠原代肝细胞揭示了LBP调控脂滴稳态的分子机制。在氧化应激(如饥饿、H₂O₂或热休克)下,HepG2细胞中LBP的mRNA表达显著上调(图1e),并通过免疫荧光共定位实验证实LBP定位于脂滴(LDs),与标志物PLIN2共定位(图1f)。棕榈酸(PA)处理的HepG2细胞中,LBP与脂滴共定位较少(图3e),表明其更倾向于结合长链不饱和甘油三酯(UFA-TG)。LBP过表达增强PA的线粒体β-氧化分解,显著提高氧气消耗率(OCR),而功能缺失突变体(如F436L)无此效应(图3f, 3g)。抗氧化剂NAC或磷脂酰胆碱(PC)通过竞争性结合LBP促使其离开脂滴,但若氧化应激未缓解,PC可能加重肝细胞损伤(图5e)。PRDX4作为氧化还原传感器,通过与LBP互作调控其在脂滴中的动态平衡:饥饿上调LBP-PRDX4互作并共定位于脂滴(图5g),而敲低PRDX4抑制LBP输出(图5h)。LBP敲除(LBP⁻/⁻)小鼠原代肝细胞几乎无脂滴形成,而过表达LBP(LBPᴷᴵ/ᴷᴵ)细胞脂滴显著增大(图2d)。这些结果揭示了LBP通过选择性捕获UFA-TG并促进其脂滴储存,同时增强PA分解供能,维持氧化还原稳态,但其过度表达或功能异常会导致脂滴蓄积和炎症反应,为脂肪肝发生提供分子基础。
小编有话说:
棕榈酸(钠)(PA)作为饱和脂肪酸的“能量担当”,在这项研究中展现了双重角色。研究发现,在氧化应激下,LBP蛋白通过增强棕榈酸(钠)的线粒体分解,大幅提升细胞供能效率,同时将易氧化的不饱和脂肪“打包”进脂滴,避免脂质过氧化损伤。这种“分工作业”机制不仅维持了肝细胞的代谢平衡,还揭示了棕榈酸(钠)(PA)在脂肪肝形成中的关键作用——它既是快速供能的“燃料”,又是LBP调控脂滴稳态的重要媒介。然而,长期高表达的LBP会导致脂滴过度蓄积,引发脂肪肝和胰岛素抵抗。这一发现为代谢性疾病治疗提供了新思路:靶向LBP活性或调控PA代谢通路,或能成为干预脂肪肝的突破口。未来,通过精准调节“能量”与“储存”的平衡,我们或许能解锁更安全的抗氧化疗法,为代谢健康保驾护航。
参考文献
Qilun Zhang Xuting Shen, Xin Yuan,et al. Lipopolysaccharide binding protein resists hepatic oxidative stress by regulating lipid droplet homeostasis [J], Nature Communications, 2024.
张启伦.LBP调控氧化应激下脂滴稳态并诱导脂肪肝的机制研究[D],中国科学技术大学,博士论文,2024.



