服务热线:15229257682
国内唯一的高脂细胞添加剂综合服务商


西安鲲创科技发展有限公司
西安鲲创科技发展有限公司
技术文献
您的位置:
首页 >>
技术文献

棕榈酸钠模拟高脂环境诱导BV-2小胶质细胞活化以研究其吞噬功能及相关信号通路
采用棕榈酸钠模拟高脂环境,在体外诱导BV-2小胶质细胞活化模型,在细胞水平验证药物对小胶质细胞激活状态、吞噬功能及相关信号通路的直接影响
2025-12-08

高脂细胞添加剂处理肝细胞(SK-Hep1、HepaRG)构建体外脂肪变性模型
通过油红O染色和Western blot分析,发现FFA处理可显著上调UGCG表达并促进脂质积累,而UGCG抑制剂处理则逆转这一效应。本研究所用高脂细胞添加剂(KC006)的品质量稳定、批间一致性高、可以直接加入到培养基中,无需反复加热助溶,为体外代谢疾病模型的构建提供了可靠保障。
2025-11-25

高脂细胞添加剂(棕榈酸钠、油酸钠)诱导肝细胞(HepG2、AML12)以建立MASLD肝细胞模型
在细胞实验方面,本研究主要采用人肝细胞系HepG2和小鼠肝细胞系AML-12,通过油酸钠(SO)和棕榈酸钠(SP)联合处理模拟MASLD的脂质蓄积环境。实验内容包括:梯度浓度SO/SP处理以确定最佳造模条件;油红O染色观察脂滴形成;CCK-8法检测细胞活力;Western blot分析ReIA、HNF1α、TG代谢相关蛋白(SREBP1c、MTP、MCAD)、ERS标志物(ATF4、GRP78、CHOP)及细胞死亡相关蛋白(cleaved caspase-3、p-MLKL);流式细胞术评估细胞凋亡;此外,还通过基因敲除(sgRNA)和过表达(pcDNA)技术调控ReIA/HNF1α表达,并结合双荧光素酶报告基因实验验证其相互调控关系及对ATF4启动子的激活作用。
2025-11-05

Biofabrication(IF/8):高糖高脂(HGPA)模拟糖尿病炎症环境处理巨噬细胞(THP-1)和成骨细胞(MC3T3-E1)以构建细胞炎症模型
细胞实验部分以THP-1源性巨噬细胞及MC3T3-E1成骨细胞为对象,模拟糖尿病炎症环境(高糖+棕榈酸钠,HGPA),评估水凝胶对细胞焦亡、ROS水平及成骨分化能力的影响。实验涵盖细胞活性、焦亡相关蛋白表达、成骨基因与蛋白检测等多维度分析,全面揭示Ac2-26与OGP在调控炎症与成骨微环境中的协同作用。
2025-10-23
EMBO J(IF/8.3):棕榈酸钠模拟高脂肥胖环境研究骨髓源性巨噬细胞(BMDMs)对脂肪细胞(3T3-L1)分化的影响
棕榈酸(钠)作为高脂微环境的核心模拟剂,在本研究中成功诱导巨噬细胞EP3下调及代谢紊乱,其作用机制涉及PPARγ/NF-κB通路。通过体外细胞共培养体系,采用棕榈酸(钠)不仅重现了肥胖相关的炎症反应,还为EP3-SPARC轴的机制解析提供关键实验基础。细胞培养技术的严谨性(如试剂浓度、处理时间标准化)确保了数据的可重复性,而蛋白质组学与表观遗传分析的结合,则深化了对巨噬细胞-脂肪细胞互作的理解。
2025-10-10
BIOMATERIALS(IF/12.9):油酸钠和棕榈酸钠联合处理RAW264.7巨噬细胞及AML12肝细胞诱导建立细胞脂变模型
在细胞实验中,研究首先在油酸钠(OA)和棕榈酸钠(PA)诱导的脂质负载RAW264.7巨噬细胞和AML12肝细胞模型中评估了纳米颗粒的摄取效率。结果显示,M2M修饰显著增强了纳米颗粒在脂质细胞中的内吞作用,其机制可能与整合素受体(α4、β2)与炎症标志物ICAM-1/VCAM-1的特异性结合有关。进一步地,在LPS诱导的M1型巨噬细胞中,O@PLGA@M有效促进M2型标志物CD206表达上调、M1型标志物CD86下调,并显著抑制炎症因子TNF-α、IL-6和IL-1β的释放。在FFA诱导的脂肪变性AML12细胞中,该纳米系统通过激活FXR-SHP-SREBP-1c通路显著降低细胞内甘油三酯(TG)积累,表现出优异的抗脂质生成和肝保护作用。
2025-09-23
JCRQ1(IF/10):高糖高脂刺激巨噬细胞(RAW 264.7、THP-1、BMDM)与心肌细胞(AC16、H9c2、NRVMs)共培养体系以研究糖尿病心肌病(DCM)
棕榈酸(PA)作为高脂诱导剂,在细胞模型中模拟糖尿病代谢应激状态,显著上调巨噬细胞和心肌细胞的S100A9表达。棕榈酸(PA)联合高糖处理可协同激活炎症通路,为研究脂毒性在DCM中的作用提供了可靠模型。细胞培养体系中,棕榈酸(PA)的稳定性和可溶解性是实验结果可重复性的关键,需选用高纯度试剂以确保无内毒素干扰。
2025-09-16
Redox Biology(IF/12):棕榈酸(PA)诱导肝细胞(AML12、原代肝细胞)脂肪变性以研究外泌体载药改善脂肪肝炎(NASH)
本研究中的棕榈酸(PA)高脂细胞添加剂是连接巨噬细胞炎症反应与肝细胞代谢紊乱的核心桥梁。通过建立稳定的棕榈酸(PA)诱导肝细胞脂肪变性模型,研究有力地证明了靶向巨噬细胞可间接改善肝细胞脂代谢。整个细胞培养体系设计严谨,涵盖了巨噬细胞的处理与肝细胞的脂质诱导,并通过条件培养基共培养、基因敲低、因子添加等多种技术手段,清晰地揭示了“巨噬细胞-炎症因子-肝细胞脂代谢-Sod1”这一作用轴线的详细机制。
2025-09-04
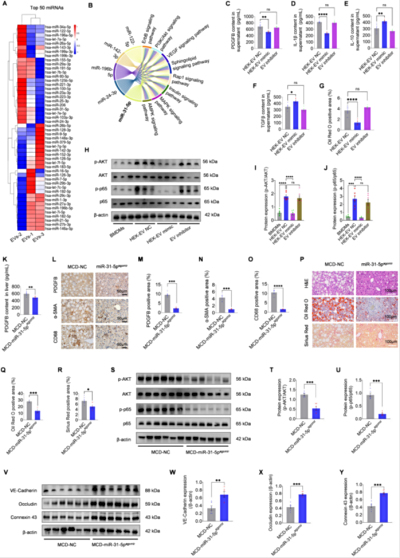
细胞外囊泡顶刊JEV(IF/14.5):棕榈酸钠诱导分离骨髓源性巨噬细胞(BMDMs)构建NAFLD细胞模型
棕榈酸钠(PA)作为高脂刺激剂,是诱导细胞脂肪变性和炎症的核心工具。PA(Kunchuang Biotechnology , KC006)用于激活BMDMs和RAW264.7细胞的NF-κB/PI3K-AKT通路,模拟NAFLD的脂毒性及纤维化微环境。细胞经PA(150μM)处理24小时后,脂质沉积(Oil Red O染色)和炎性因子(ELISA)显著升高,而EVs或miR-31-5p干预有效逆转该表型。试剂使用严格遵循浓度梯度(PDGFB重组蛋白:10-100ng/mL;LPS:100ng/mL),并通过凋亡检测(Annexin V/PI)、Western blot等验证模型可靠性。
2025-08-25
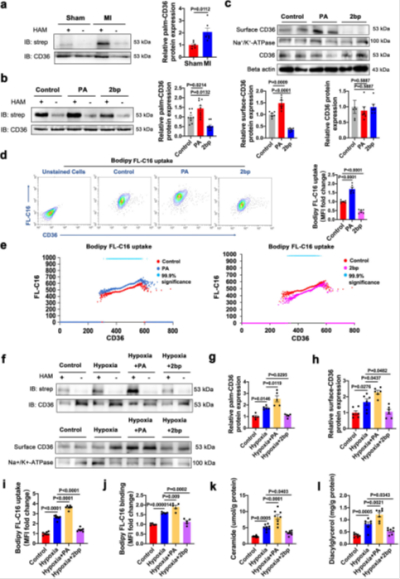
IF/15.7:棕榈酸诱导缺氧心肌细胞CD36棕榈酰化以模拟心肌梗死病理环境
心肌梗死(MI)后心肌能量底物代谢的改变和线粒体损伤导致心脏结构和功能异常。脂肪酸转位酶CD36(CD36)在调节脂质稳态和线粒体代谢中起着关键作用。本文证明了在脂质代谢紊乱和线粒体功能障碍的小鼠MI模型中,抑制棕榈酰化的CD36产生的有益作用。从机制上讲,抑制CD36棕榈酰化通过双重机制增强心脏功能:首先,通过减轻质膜CD36介导的脂肪酸超负荷,从而恢复脂质代谢平衡;其次,通过增强线粒体CD36-PGAM5信号轴的活性并调节Fundc1和Drp1去磷酸化,从而提高线粒体自噬效率。总体而言,本研究强调了CD36棕榈酰化通过调节下游代谢信号通路在保护心脏功能方面的重要作用,表明靶向CD36棕榈酰化可能是MI的一种有前途的治疗策略。
2025-08-11
资讯中心
服务热线
15229257682


关注公众号
联系我们
· 网站导航
· 联系方式
网站首页
案例展示
技术分享
联系我们
Copyright © 版权所有 西安鲲创科技发展有限公司
关于我们
产品中心
联系电话:15229257682
联系邮箱:Ewallcage@163.com
公司地址:陕西省西安市碑林区友谊东路334号