Biofabrication(IF/8.2):高糖/棕榈酸(HGPA)模拟体外糖尿病炎症环境并诱导巨噬细胞焦亡
棕榈酸作为高脂细胞添加剂,其稳定性和生物活性对模拟糖尿病病理微环境至关重要。本研究采用的PA(Kunchuang Biotechnology)纯度高达99%,可精准诱导巨噬细胞焦亡及成骨抑制,为糖尿病相关炎症机制研究提供可靠工具。未来可进一步开发基于PA的疾病模型试剂盒,助力药物筛选与机制探索,推动精准医疗发展。
棕榈酸(PA)作为饱和脂肪酸,在实验中用于模拟糖尿病相关的脂毒性应激,激活NLRP3炎症小体并诱导巨噬细胞焦亡。细胞处理中,THP-1细胞经PMA分化为M0巨噬细胞后,暴露于高糖(25.5mM)和PA(200μM)环境,通过CCK-8筛选出PA最佳浓度(图1B),并联合LPS构建炎症模型。MC3T3-E1成骨细胞在HGPA(300μMPA)中培养,通过ALP染色、qPCR和Westernblot评估成骨抑制及OGP的修复作用。实验表明,PA通过脂毒性加剧炎症和氧化应激,而Ac2-26/OGP/GPPG可靶向调控此过程。
Biofabrication(IF/8.2):高糖/棕榈酸(HGPA)模拟体外糖尿病炎症环境并诱导巨噬细胞焦亡
1. 前言
糖尿病性牙周炎(DP)患者因高血糖导致活性氧(ROS)积累和微环境酸化,抑制巨噬细胞功能并加剧炎症反应,进一步阻碍骨修复。巨噬细胞焦亡(pyroptosis)通过NLRP3/Caspase-1/GSDMD通路被激活,而ANXA1蛋白的表达下调可能加剧这一过程。当前治疗手段难以精准调控炎症微环境并同步促进骨再生,亟需开发智能递送系统以靶向调节免疫反应并改善成骨功能。
本研究设计了一种ROS/pH响应的智能水凝胶(GPPG),负载ANXA1衍生肽Ac2-26和成骨肽OGP,通过抑制巨噬细胞焦亡并促进成骨分化实现DP治疗。水凝胶基于苯硼酸酯动态键构建,可响应炎症微环境释放药物。
其中,细胞实验通过体外模型验证机制:THP-1来源的巨噬细胞经高糖/棕榈酸(HGPA)诱导模拟糖尿病炎症,检测ANXA1表达、焦亡相关蛋白及ROS水平;MC3T3-E1成骨细胞评估HGPA对成骨分化的抑制及OGP的修复作用。结果显示,HGPA降低ANXA1表达并激活NLRP3通路,而Ac2-26通过恢复ANXA1抑制焦亡,OGP则逆转成骨基因表达下调。
2.高糖高脂试剂盒
文中采用棕榈酸(Palmitic Acid)作为高脂细胞添加剂(货号KC003,Kunchuang Biotechnology, 鲲创生物)作为游离脂肪酸(free fatty acids,FFAs)处理细胞。

此外,也可以直接使用高糖高脂试剂盒(货号KT001,高糖高脂试剂盒 ),该试剂盒包括了葡萄糖、棕榈酸(钠)和溶剂对照,能够直接使用,具备溶剂无毒、常温无析出,浓度准确,无需加热助溶等优点,显著减少操作步骤,提升实验的稳定性。
3.细胞处理及部分实验结果
为了模拟糖尿病的典型炎症条件,M0巨噬细胞随后暴露于500 ng ml−1LPS,并结合HGPA设置(葡萄糖25.5mmol l−1+ PA 200 µmol l−1)或对照牛血清白蛋白(BSA)设置(葡萄糖5.5mmol l−1+ BSA 200µmol l−1)诱导8h。
文中巨噬细胞实验(图1)显示,HGPA处理显著降低ANXA1(图1C-D),并诱导NLRP3、GSDMD-N末端、CleavedCaspase-1等焦亡标志物表达(图1G-H)。扫描电镜(图1E)显示HGPA组细胞膜孔洞增多,形态肿胀,提示焦亡特征。ROS检测(图1I)证实HGPA组荧光强度升高,而Ac2-26/GPPG显著降低ROS水平(图3E)。通过siRNA敲低NLRP3(图1J-K)或Disulfiram抑制GSDMD(图1F),焦亡相关蛋白表达受抑,验证通路依赖性。
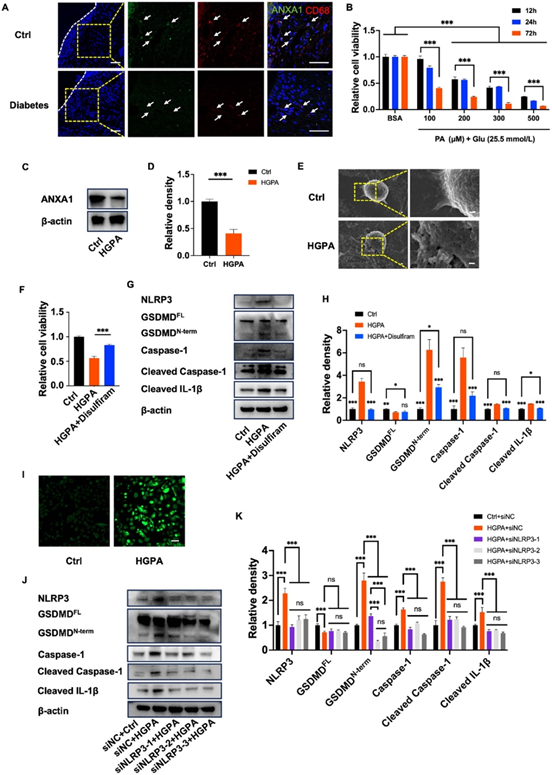
图1 ANXA1在糖尿病牙周炎中随巨噬细胞的增生而降低。(A)牙周组织切片免疫荧光双染色。 (B)巨噬细胞用LPS(500ngm l−1)和对照BSA(5.5mmol l−1葡萄糖)或不同浓度的PA(25.5 mmol l−1葡萄糖)处理不同时间,并用CCK-8测定法进行评价。(C)免疫印迹法检测对照组和HGPA组巨噬细胞ANXA1和β-actin的表达。(D)(C)的统计分析。(E)扫描电镜图像显示HGPA处理后巨噬细胞的形态发生了改变。(F)LPS(500 ng ml−1)和对照BSA(5.5mmol l−1葡萄糖)或200µmol l−1浓度PA(25.5mmol l−1葡萄糖)或200µmol l−1浓度PA(25.5 mmol l−1葡萄糖)和双硫仑处理的巨噬细胞的CCK-8测定。(G)对照组、HGPA组和HGPA+双硫仑组巨噬细胞的NLRP3、GSDMD全长、GSDMD-N末端、Caspase-1、裂解Caspase-1、裂解IL-1β和β-actin的免疫印迹图像。(H)(g)的统计分析。(I)通过DCFH-DA测量细胞内ROS生成。(J)对照组、HGPA组、HGPA+siNLRP3-1组、HGPA+siNLRP3-2组和HGPA+siNLRP3-3组巨噬细胞的NLRP3、GSDMD全长、GSDMD-N末端、Caspase-1、裂解Caspase-1、裂解IL-1β和β-肌动蛋白的免疫印迹图像。(K)(j)的统计分析。
成骨实验中,HGPA抑制ALP活性(图2C-D)及矿化结节形成(图2E-F),OGP/GPPG恢复RUNX2、OCN等基因表达(图2G-I)。水凝胶的SEM图像显示多孔结构,支持药物缓释;活/死染色证实GPPG生物相容性优异,细胞铺展良好。Westernblot(图3C-D)进一步表明,Ac2-26/GPPG显著下调NLRP3通路蛋白,且与OGP协同增强抗焦亡效果。
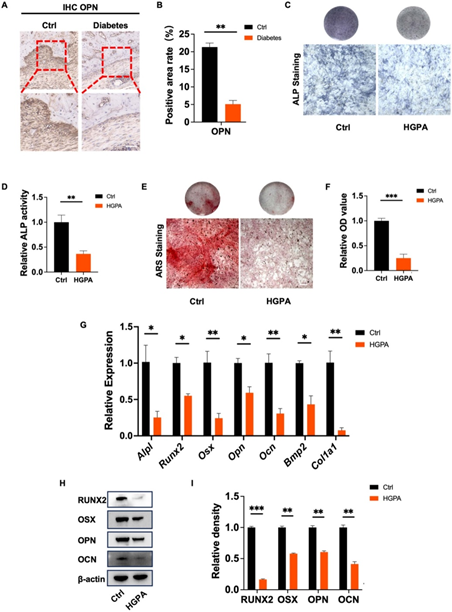
图2与糖尿病相关的炎性疾病中的成骨活性降低
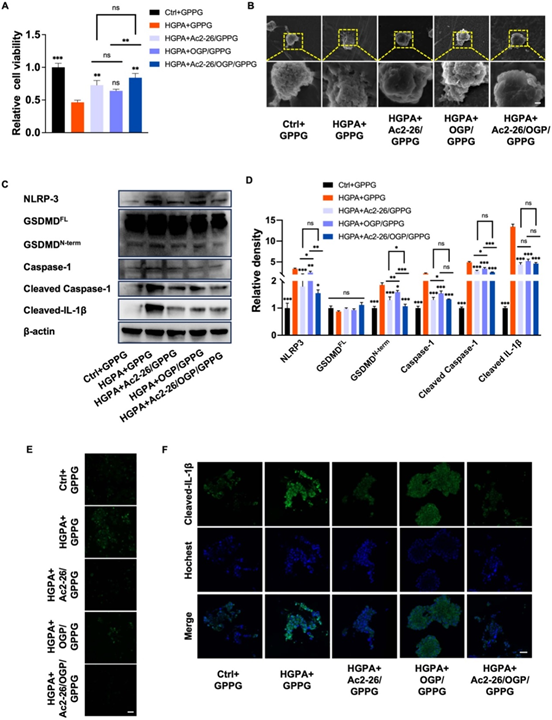
图3 具有Ac2-26的GPPG水凝胶减少糖尿病炎症中的巨噬细胞焦亡
4.总结
糖尿病背景的牙周炎患者的颅面骨缺损愈合长期以来一直很困难,这是由于血糖水平升高导致活性氧(ROS)的过度产生和低pH环境。这些条件对巨噬细胞的功能产生负面影响,使炎症和氧化应激恶化,并最终阻碍成骨细胞的骨修复潜力。在这项研究中,我们首次发现,在糖尿病牙周炎(DP)环境中,巨噬细胞中的膜联蛋白A1(ANXA1)表达减少,NLRP3/Caspase-1/GSDMD信号通路激活,最终增加巨噬细胞焦亡。接下来,我们开发了一种新的GPPG智能水凝胶系统,该系统具有ROS和pH响应性,并负载了Ac2-26,ANXA1生物活性肽和成骨肽OGP。我们发现Ac2-26/OGP/GPPG可以有效地减少ROS,通过ANXA1/NLRP3/Caspase-1/GSDMD途径减轻巨噬细胞的焦亡,并增强成骨分化。Ac2-26/OGP/GPPG对牙周炎所致糖尿病大鼠牙缺失模型的调节作用和骨缺损修复作用也得到了进一步验证。总之,我们的研究揭示了ANXA1对糖尿病牙周炎患者巨噬细胞凋亡的影响,在此基础上,我们引入了一种有前途的创新水凝胶系统,通过靶向巨噬细胞凋亡和增强成骨潜力来改善DP患者的骨缺损修复
小编有话说:
棕榈酸(PA)作为饱和脂肪酸,在实验中用于模拟糖尿病相关的脂毒性应激,激活NLRP3炎症小体并诱导巨噬细胞焦亡。细胞处理中,THP-1细胞经PMA分化为M0巨噬细胞后,暴露于高糖(25.5mM)和PA(200μM)环境,通过CCK-8筛选出PA最佳浓度(图1B),并联合LPS构建炎症模型。MC3T3-E1成骨细胞在HGPA(300μMPA)中培养,通过ALP染色、qPCR和Westernblot评估成骨抑制及OGP的修复作用。实验表明,PA通过脂毒性加剧炎症和氧化应激,而Ac2-26/OGP/GPPG可靶向调控此过程。
棕榈酸作为高脂细胞添加剂,其稳定性和生物活性对模拟糖尿病病理微环境至关重要。本研究采用的PA(Kunchuang Biotechnology)纯度高达99%,可精准诱导巨噬细胞焦亡及成骨抑制,为糖尿病相关炎症机制研究提供可靠工具。未来可进一步开发基于PA的疾病模型试剂盒,助力药物筛选与机制探索,推动精准医疗发展。
参考文献
Ruoyu Li, Wenfeng Li ,et al. Ameliorating macrophage pyroptosis via ANXA1/NLRP3/Caspase-1/GSDMD pathway: Ac2- 26/OGP-loaded intelligent hydrogel enhances bone healing in diabetic periodontitis [J], Biofabrication, 2025.



