Cell Death Discovery(IF/6.1):高脂细胞添加剂诱导肝细胞建立脂肪变性模型(脂质沉积与细胞损伤)
作为高脂细胞添加剂供应商,我们提供严格验证的油酸(钠)和棕榈酸(钠)高脂细胞添加剂(批次差异<1%),适合多种细胞模型,助力精准模拟脂毒性微环境,加速代谢疾病机制研究与药物开发。
本研究通过油酸钠(SO)和棕榈酸钠(SP)联合处理肝细胞系(HepG2/LO2),证实其以浓度梯度(125/62.5-500/250μM)诱导脂滴积累、甘油三酯(TG)含量显著升高,并抑制RelA/HNF1α互作,破坏脂代谢稳态。SO/SP激活凋亡(cleaved caspase-3)和坏死性凋亡(p-MLKL),而抑制剂Necrostatin-1和Z-VAD可分别缓解脂毒性和细胞死亡。脂质组学显示长链TG和鞘脂类(Cer/SPH)积累,伴随线粒体功能受损(ETC活性下降50%)、氧化应激(MDA升高2倍)及ER应激标志物(ATF4/GRP78)下调。RelA敲除加剧脂代谢紊乱,而过表达则显著改善表型。
Cell Death Discovery(IF/6.1):高脂细胞添加剂诱导肝细胞建立脂肪变性模型(脂质沉积与细胞损伤)
1. 前言
代谢功能障碍相关脂肪肝病(MASLD)是代谢异常引发的慢性肝病,以肝细胞脂质过度蓄积为核心病理特征,伴随内质网(ER)应激、线粒体氧化应激及细胞程序性死亡(凋亡和坏死性凋亡)。RelA(NF-κB p65)和HNF1α是调控脂代谢和ER应激的关键转录因子,二者在正常肝细胞中通过启动子互作形成正反馈环路,协同维持脂代谢稳态。然而,脂质蓄积会破坏这一互作,导致RelA信号受损,进一步通过抑制ATF4/GRP78表达加剧ER应激,并通过脂质重塑(如长链甘油三酯积累、鞘脂类增加)诱发线粒体功能障碍和氧化损伤。这种恶性循环最终驱动肝细胞凋亡和坏死性凋亡,加速MASLD向纤维化和肝癌进展。本研究揭示了RelA/HNF1α信号轴在MASLD中的核心调控作用,为靶向干预提供了新思路。
作者通过高脂饮食(HFD)诱导小鼠MASLD模型,并结合油酸(钠)/棕榈酸(钠)(SO/SP)处理肝细胞系建立体外脂肪变性模型,利用基因敲除/过表达、双荧光素酶报告基因及脂质组学,解析RelA/HNF1α互作及脂代谢重塑机制。在HepG2和LO2细胞中,通过油酸(钠)/棕榈酸(钠)诱导脂肪变性,结合RelA或HNF1α基因操作,评估脂质沉积、TG含量、细胞活力、凋亡/坏死性凋亡标志物(cleaved caspase-3/p-MLKL)及ER应激相关蛋白(ATF4、GRP78)表达。
2. 高脂细胞添加剂
文中采用油酸(钠)/棕榈酸(钠)(SO/SP)作为高脂细胞添加剂(货号KC006,Kunchuang, China, 鲲创科技)处理细胞48小时。

该试剂盒包括了独立包装的油酸(钠)、棕榈酸(钠)和溶剂对照,能够直接使用,具备溶剂无毒、常温无析出,无需多次加热助溶等优点,显著减少操作步骤,提升实验的稳定性。
3.细胞处理及部分实验结果
通过体外肝细胞模型(HepG2和LO2)系统揭示了RelA信号在MASLD中的调控机制(图1-3、7)。图1A-E显示,SO/SP以浓度依赖性(125/62.5至500/250μM)诱导肝细胞脂质沉积(油红O染色)、TG含量升高(250/125μM时TG增加3倍,P<0.01)及细胞活力下降(高浓度抑制>50%),同时显著下调RelA和HNF1α蛋白表达(图1E),表明脂毒性直接抑制二者转录活性。
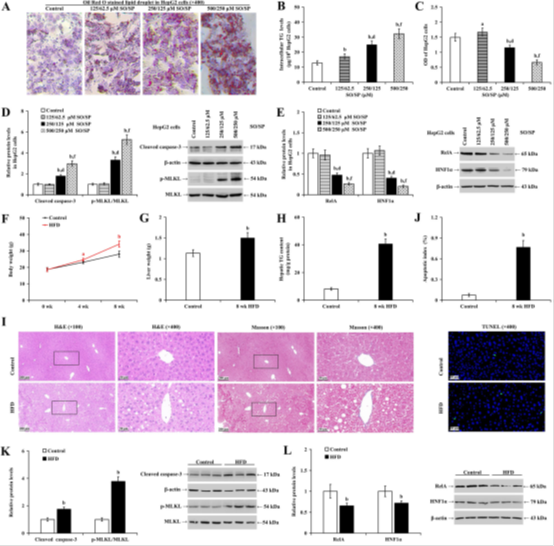
图1 脂肪肝肝细胞在MASLD中表现出RelA和HNF1α水平降低
图2A-E通过双荧光素酶报告基因实验证实,RelA与HNF1α在正常肝细胞中通过结合对方启动子区域相互激活转录(野生型启动子活性提高2倍,P<0.01),但在SO/SP处理下此互作被破坏。例如,RelA过表达可使HNF1α启动子活性提升1.8倍(图2D),而突变型启动子活性仅增加0.3倍(P<0.05),提示脂质沉积通过破坏RelA/HNF1α互作削弱其代谢调控功能。
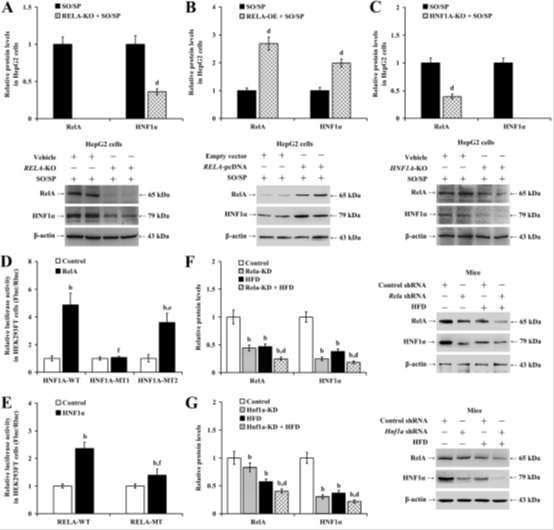
图2 肝细胞脂肪变性过程中RelA和HNF 1 α之间缺乏相互转录激活
图3A-J进一步验证RelA对脂肪变性的保护作用:RelA敲除(KO)加剧SO/SP诱导的脂滴积累(图3A)、TG含量(图3B,增加40%,P<0.01)及细胞凋亡(cleaved caspase-3升高2.5倍,图3E)。相反,RelA过表达(OE)显著缓解上述表型(图3F-J,TG降低30%,P<0.01),并抑制坏死性凋亡标志物p-MLKL(降低50%,图3J),表明RelA通过调控脂代谢和细胞死亡通路缓解MASLD。
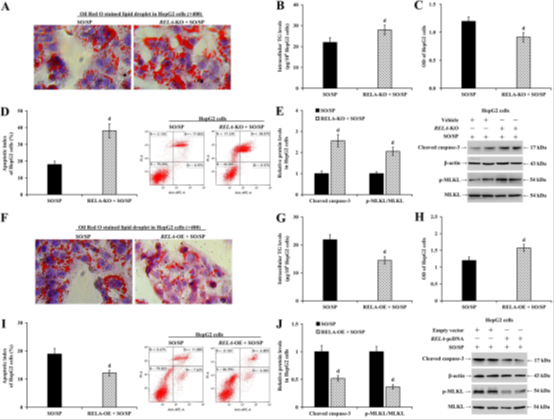
图3 RelA减少SO/SP诱导的HepG 2细胞中的脂肪变性
随后的实验显示,坏死性凋亡抑制剂Necrostatin-1和凋亡抑制剂Z-VAD可分别减少脂质沉积及细胞死亡(p-MLKL和cleaved caspase-3降低60%,P<0.01),证明脂毒性通过激活凋亡/坏死性凋亡通路加速MASLD进展。此外,脂质组学分析显示,SO/SP处理导致脂质重塑(如长链TG增加、鞘脂类Cer/SPH升高)、线粒体功能受损及氧化损伤。RelA敲除进一步加剧这些表型,而RelA过表达通过上调ATF4/GRP78(ER应激保护因子)改善脂代谢。
综上,细胞实验通过基因敲除/过表达、脂质组学、细胞死亡通路,阐明RelA/HNF1α信号轴在脂代谢和ER应激中的核心地位,为靶向干预提供了实验依据。
小编有话说:
本研究通过油酸钠(SO)和棕榈酸钠(SP)联合处理肝细胞系(HepG2/LO2),证实其以浓度梯度(125/62.5-500/250μM)诱导脂滴积累、甘油三酯(TG)含量显著升高,并抑制RelA/HNF1α互作,破坏脂代谢稳态。SO/SP激活凋亡(cleaved caspase-3)和坏死性凋亡(p-MLKL),而抑制剂Necrostatin-1和Z-VAD可分别缓解脂毒性和细胞死亡。脂质组学显示长链TG和鞘脂类(Cer/SPH)积累,伴随线粒体功能受损(ETC活性下降50%)、氧化应激(MDA升高2倍)及ER应激标志物(ATF4/GRP78)下调。RelA敲除加剧脂代谢紊乱,而过表达则显著改善表型。
作为高脂细胞添加剂供应商,我们提供严格验证的油酸(钠)和棕榈酸(钠)高脂细胞添加剂(批次差异<1%),适合多种细胞模型,助力精准模拟脂毒性微环境,加速代谢疾病机制研究与药物开发。
参考文献
Yihuai He,Jinlian Jiang ,et al. Impaired RelA signaling and lipid metabolism dysregulation in hepatocytes: driving forces in the progression of metabolic dysfunction-associated steatotic liver disease [J], Cell Death Discovery, 2025.



