IF/15.7:棕榈酸诱导缺氧心肌细胞CD36棕榈酰化以模拟心肌梗死病理环境
棕榈酸(PA)作为棕榈酰化诱导剂(160μM,24h),在缺氧心肌细胞中模拟MI病理环境,加剧CD36质膜定位、FA超载及线粒体损伤
心肌梗死(MI)后心肌能量底物代谢的改变和线粒体损伤导致心脏结构和功能异常。脂肪酸转位酶CD36(CD36)在调节脂质稳态和线粒体代谢中起着关键作用。本文证明了在脂质代谢紊乱和线粒体功能障碍的小鼠MI模型中,抑制棕榈酰化的CD36产生的有益作用。从机制上讲,抑制CD36棕榈酰化通过双重机制增强心脏功能:首先,通过减轻质膜CD36介导的脂肪酸超负荷,从而恢复脂质代谢平衡;其次,通过增强线粒体CD36-PGAM5信号轴的活性并调节Fundc1和Drp1去磷酸化,从而提高线粒体自噬效率。总体而言,本研究强调了CD36棕榈酰化通过调节下游代谢信号通路在保护心脏功能方面的重要作用,表明靶向CD36棕榈酰化可能是MI的一种有前途的治疗策略。
IF/15.7:棕榈酸诱导缺氧心肌细胞CD36棕榈酰化以模拟心肌梗死病理环境
Nature Communications
1. 前言
心肌梗死(MI)后心肌能量代谢紊乱与线粒体损伤是导致心功能恶化的核心机制。脂肪酸转位酶CD36通过调控脂质稳态与线粒体代谢发挥关键作用,其功能受棕榈酰化修饰(一种蛋白质翻译后修饰)的调控。棕榈酰化通过将棕榈酸共价结合至CD36半胱氨酸残基,影响其亚细胞定位:棕榈酰化促进CD36向质膜转位,加剧脂肪酸(FA)摄取与氧化失衡,导致脂毒性代谢物(如神经酰胺、DAG)积累,进一步损害线粒体功能与自噬。MI后心脏表现为线粒体氧化磷酸化能力下降、ATP合成减少及脂质过氧化加剧,形成代谢恶性循环。因此,靶向CD36棕榈酰化可能通过双重机制——减少质膜CD36介导的脂质超载、增强线粒体CD36-PGAM5信号轴的自噬调控——成为改善心脏功能的新策略。
本文采用如下技术路线:研究整合多组学(蛋白质组、代谢组、单细胞转录组)分析MI小鼠心肌代谢重编程特征,锁定CD36为关键调控因子;通过药理学抑制(SSO)及基因编辑(CD36棕榈酰化位点突变AA-SS-CD36)验证其对心脏功能的保护作用,并深入探索CD36-PGAM5-线粒体自噬轴的分子机制。
细胞实验内容中,原代新生小鼠心室肌细胞(NMVCs)培养中建立缺氧模型,使用棕榈酸(PA)诱导或2-溴棕榈酸(2-bp)抑制CD36棕榈酰化,结合免疫荧光、Western blot及双色流式验证棕榈酰化对CD36膜定位及FA摄取的影响;通过线粒体呼吸检测、活性氧及自噬标志物(分析线粒体功能与自噬通量,并利用Co-IP揭示CD36与PGAM5互作。
2. 高脂细胞添加剂
文中采用棕榈酸作为高脂细胞添加剂(现货号KC004,Kunchuang Xi’an)处理NMVCs细胞,以模拟高脂的心肌梗死病理环境。

该试剂(KC004)包括了10ml的10mmol/L无菌包装的棕榈酸和5ml的溶剂对照,能够直接使用,具备溶剂无毒、常温无析出,无需加热助溶等优点,显著减少操作步骤,提升实验的稳定性。其中,棕榈酸可以用来诱导细胞损伤和炎症。
3.细胞处理及部分实验结果
细胞实验核心围绕CD36棕榈酰化对心肌细胞代谢与自噬的调控展开。
3.1棕榈酰化动态调控CD36膜定位与FA摄取
1)棕榈酸(PA)处理(160μM,24h)显著提升心肌细胞CD36棕榈酰化水平(IP-ABE检测),并促进其向质膜转位(Western blot及Na⁺/K⁺-ATPase共定位免疫荧光),增强Bodipy FL-C16结合与摄取(双色流式:PA组MFI增加>40%,P<0.01)(图1)。
2)2-bp处理(25μM,24h)则抑制棕榈酰化,减少质膜CD36定位(图1c),降低FA摄取(流式显示MFI下降35%)。在缺氧模型中,PA加剧FA摄取与脂毒性代谢物积累(神经酰胺↑1.8倍,DAG↑1.5倍),而2-BP逆转此表型(图1i-l)。
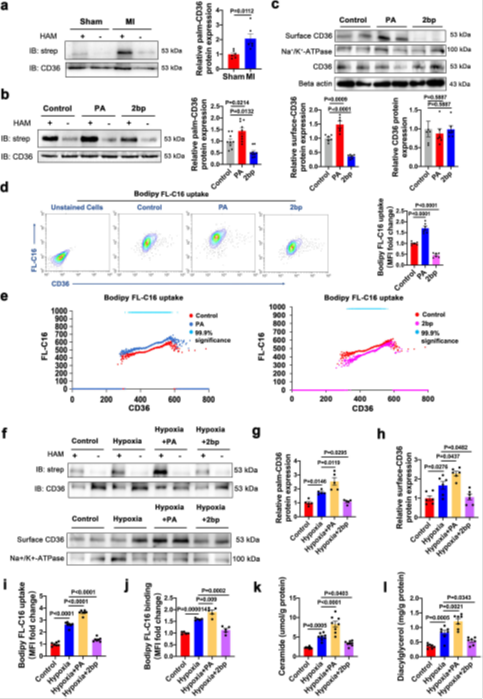
图1棕榈酸PA和2-溴棕榈酸(2-bp)处理改变了心肌细胞CD36的质膜定位及其细胞FA摄取活性
3.2基因突变验证棕榈酰化功能必要性
1)转染棕榈酰化位点突变体AA-SS-CD36(Cys3/7→Ala,Cys464/466→Ser)后,质膜CD36降低60%(Western blot),亚细胞(胞浆/细胞器)CD36增加(图2b)。双色流式显示,即使CD36总表达量相似,AA-SS组FA摄取较野生型(WT-CD36)减少50%(图2c-d),证实棕榈酰化独立调控CD36功能。
2)缺氧损伤模型中,AA-SS-CD36转染改善线粒体功能:OCR检测显示基础呼吸与ATP产量恢复(图2g),mtROS生成减少30%(MitoSOX荧光强度↓,图2h),并降低神经酰胺/DAG积累(图2e-f)。
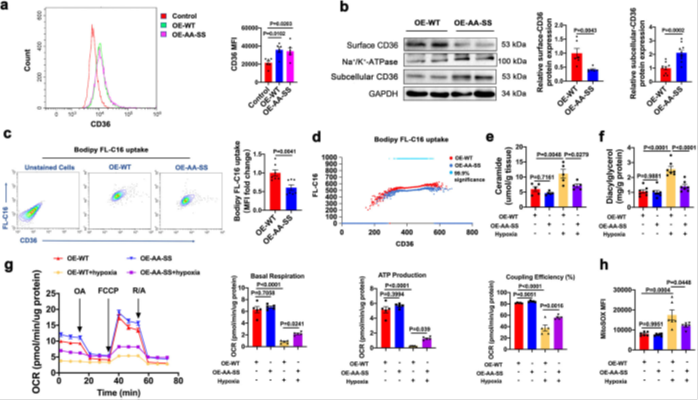
图2棕榈酰化对于CD36的质膜定位必不可少且对心肌细胞中的线粒体功能和FA摄取具有影响
3.3 CD36-PGAM5互作调控自噬
1)CD36棕榈酰化抑制(AA-SS-CD36)促进其向线粒体转位,增强与磷酸酶PGAM5结合(Co-IP验证,结合量↑2.2倍)(图3)。
2)PGAM5稳定性提升:AA-SS组PGAM5蛋白半衰期延长(CHX追踪实验),泛素化水平降低60%(Ub-PGAM5Co-IP,图3k),导致线粒体PGAM5积累(图3f-h)。
3)PGAM5激活线粒体自噬(线粒体自噬):通过去磷酸化FUNDC1(p-FUNDC1↓40%)及DRP1(p-Drp1S637↓),促进线粒体分裂与自噬体形成(TEM显示自噬体增多,图3i)。shRNA敲低PGAM5可阻断AA-SS-CD36诱导的自噬(Cyto-ID荧光强度↓50%,图3e),证实PGAM5为下游关键介质。
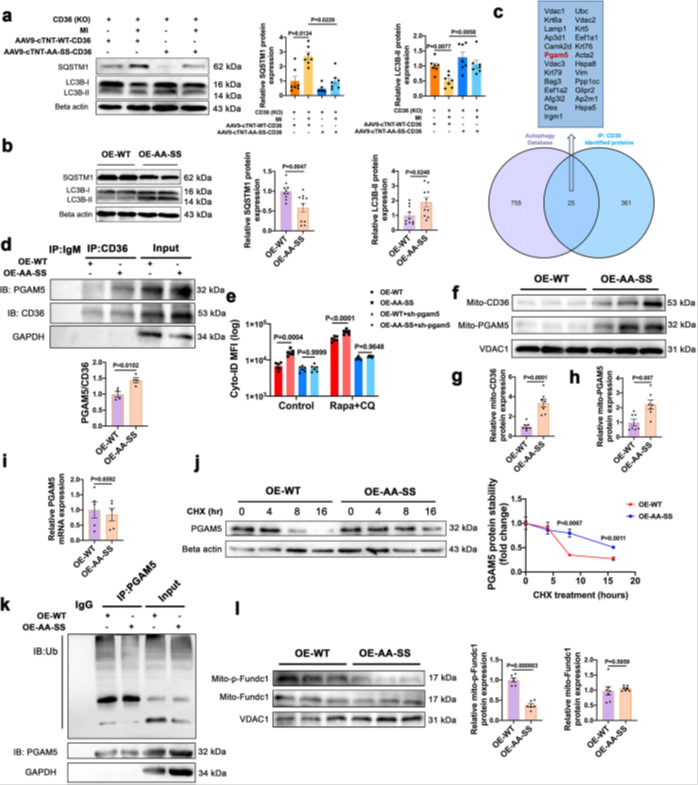
图3 通过PGAM5深入了解CD36棕榈酰化在心肌细胞自噬中的作用
4.总结
心肌梗死(MI)后心肌能量底物代谢的改变和线粒体损伤导致心脏结构和功能异常。脂肪酸转位酶CD36(CD36)在调节脂质稳态和线粒体代谢中起着关键作用。本文证明了在脂质代谢紊乱和线粒体功能障碍的小鼠MI模型中,抑制棕榈酰化的CD36产生的有益作用。从机制上讲,抑制CD36棕榈酰化通过双重机制增强心脏功能:首先,通过减轻质膜CD36介导的脂肪酸超负荷,从而恢复脂质代谢平衡;其次,通过增强线粒体CD36-PGAM5信号轴的活性并调节Fundc1和Drp1去磷酸化,从而提高线粒体自噬效率。总体而言,本研究强调了CD36棕榈酰化通过调节下游代谢信号通路在保护心脏功能方面的重要作用,表明靶向CD36棕榈酰化可能是MI的一种有前途的治疗策略。
小编有话说:
棕榈酸(PA)作为棕榈酰化诱导剂(160μM,24h),在缺氧心肌细胞中模拟MI病理环境,加剧CD36质膜定位、FA超载及线粒体损伤;而2-bp(25μM)通过抑制CD36棕榈酰化逆转上述表型。原代心肌细胞培养采用新生小鼠心室组织酶解分离(0.25%胰蛋白酶+胶原酶II),于含10%FBS的DMEM中培养,缺氧处理(5%CO₂,95%N₂)24小时建立代谢应激模型。
鲲创(Kunchuang)生物科技提供的高纯度棕榈酸(>99%),严格遵循细胞代谢研究标准,为模拟脂毒性心肌损伤提供关键试剂,其稳定性与生物活性保障了棕榈酰化调控研究的可靠性。本研究证实PA精准诱导CD36棕榈酰化及FA代谢紊乱,助力靶向药物开发。选用本产品可确保实验可重复性,推动心肌代谢疾病机制研究与治疗策略创新。
参考文献
Zhang Qingwei, et al. Inhibiting CD36 palmitoylation improves cardiac function post-infarction by regulating lipid metabolic homeostasis and autophagy. Nat Commun. 2025 Jul 17;16(1):6602. doi: 10.1038/s41467-025-61875-y.



