HepG2高脂细胞模型建立方法(非酒精性脂肪性肝细胞模型)
本研究建立了油酸钠和棕榈酸钠诱导的非酒精性脂肪性肝细胞模型,成功诱导细胞内脂质积累、脂肪形成、氧化应激以及脂质积累引起的线粒体损伤
本文采用250μmol/L棕榈酸钠溶液联合500μmol/L油酸钠的游离脂肪酸(FFAs)溶液处理HepG2细胞24小时,成功建立HepG2细胞高脂细胞模型(非酒精性脂肪性肝细胞模型),成功诱导细胞内脂质积累、脂肪形成、氧化应激以及脂质积累引起的线粒体损伤,包括ROS产生、线粒体膜电位异常和ATP紊乱等,基于该模型用药,验证了来源于顶乳头干细胞(SCAPs)的外泌体能够通过调节脂肪酸代谢和减少炎症改善NASH。
HepG2高脂细胞模型建立方法(非酒精性脂肪性肝细胞模型)
Molecular Medicine(IF=6)
1. 前言
非酒精性脂肪性肝病(NAFLD)是一种由体内代谢失衡诱导的慢性肝病,其特征为肝细胞中的异常脂质蓄积。在持续刺激下,其从单纯脂肪变性进展为炎症反应、纤维化和肝细胞损伤,最终导致终末期肝癌。NASH代表NAFLD的更晚期表现。代谢性疾病,如2型糖尿病、胰岛素抵抗和肥胖,与NAFLD密切相关。
本研究建立了油酸钠和棕榈酸钠诱导的非酒精性脂肪性肝细胞模型,成功诱导细胞内脂质积累、脂肪形成、氧化应激以及脂质积累引起的线粒体损伤,包括ROS产生、线粒体膜电位异常和ATP紊乱等,为后期药物验证奠定了基础,最终验证了来源于顶乳头干细胞(SCAPs)的外泌体能够通过调节脂肪酸代谢和减少炎症改善NASH。
2. 配置游离脂肪酸FFAs
游离脂肪酸FFAs为西安鲲创科技发展有限公司(Kunchuang,China)的高脂细胞添加剂(棕榈酸钠、油酸钠)(货号KC006),高脂细胞添加剂为液体即用型,具有溶剂无毒、常温无析出、浓度精准,无需多次加热助溶等特点。实际使用时,只需要将试剂按照比例加入到完全培养基中即可。

3. 细胞培养和处理
细胞培养基由DMEM、10%FBS和1%青霉素-链霉素组成。将人肝细胞癌细胞HepG2在上述培养基中在37°C培养箱中用5% CO2培养。细胞每2-3天传代一次。将细胞用0.5mM 油酸钠(OA)、0.25mM的棕榈酸钠(PA)(Kunchuang,China)处理24小时。
实际操作时,需要待细胞生长至80-100%汇合度时,换成新鲜的含血清、含双抗(10% FBS、1% P/S)的完全培养基,按上述浓度滴加高脂细胞添加剂,对照组加入等量溶剂对照,试剂轻柔地加入到细胞培养皿中,避免局部高浓度试剂损伤细胞,混匀后将细胞放入细胞孵箱中继续培养。
此外,上述作用浓度可能会因加药时的细胞密度、代数、状态或耐药性的不同而有所区别。因此,建议具体实验中,先通过浓度、时间梯度实验,寻找出适合于所用细胞的最佳药物作用浓度和最佳作用时间,一般建议作用48-72小时。
4. 细胞检测
1)细胞毒性、甘油三酯含量和血清炎性细胞因子水平的评估
血清中天冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)水平反映了肝毒性的程度。根据ALT/AST测定试剂盒提供的说明书测量其浓度。按照TG测定试剂盒测试甘油三酯含量。按照生产商说明,使用酶联免疫吸附试验试剂盒测定血清中肿瘤坏死因子-α(TNF-α)和白细胞介素-6(IL-6)的水平。
2)细胞油红O染色测定
在使用“细胞培养和处理”部分中描述的方法处理HepG2细胞24小时后,将细胞用4%多聚甲醛在室温下固定10分钟。然后将它们与尼罗红染色溶液在黑暗中孵育10分钟,随后对细胞核进行DAPI染色。同样,在室温下用4%多聚甲醛固定细胞10分钟后,用油红O染色。最后,在显微镜下观察细胞。
3)细胞ROS检测
在6孔板中以1×105个细胞/孔的密度接种细胞。去除培养基,加入ROS荧光探针溶液。在37°C孵育30min,在荧光显微镜下观察。需要说明的是,当达到时间点时,除去含或不含药物的培养基,使用PBS洗涤细胞多次后再观察。
4)蛋白质印迹
通过用RIPA缓冲液裂解,从肝组织、外泌体和肝细胞中提取蛋白质。使用BCA蛋白质测定试剂盒测定总蛋白质浓度。使用12%十二烷基硫酸钠-聚丙烯酰胺凝胶分离裂解物。电泳后,将凝胶中的蛋白质转移到聚偏二氟乙烯膜上。然后用5%牛血清白蛋白封闭膜1小时。封闭后,将膜与抗SREBP-1c、AMPK、p-AMPK、PPAR-α、CPT-1α、NF-κB、P-NF-κB、TSG101、CD63、CD81、钙连接蛋白和β-肌动蛋白的一抗在4℃下孵育过夜。最后,将膜与抗兔IgG二抗在室温下孵育1小时。使用ECLPlus检测系统检测蛋白质水平。
4.结果与分析
体外细胞实验结果如图1A所示,将细胞分为三组:第一组用常规培养基正常诱导,第二组用OA/PA诱导HepG2细胞构建NASH模型24h,第三组在OA/PA诱导的基础上与exosomes(来源于顶乳头干细胞的外泌体)共孵育。
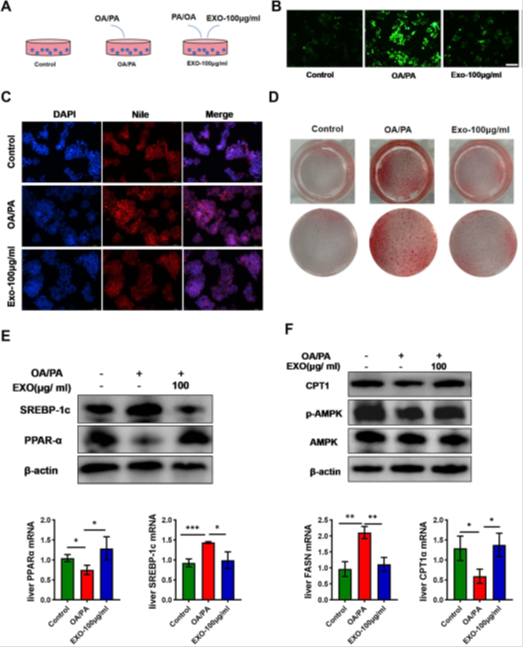
图1 根尖乳头干细胞(SCAPS)外来体在体外改善NASH。A三组细胞的处理方案。BROS荧光染色后各组细胞的荧光强度。C尼罗红和DAPI染色后各组细胞的荧光强度。D油红染色后各组细胞染色强度。E采用定量聚合酶链反应(qPCR)(n=3)对肝组织中的PPARα和SREBP1c的mRNA水平进行定量。通过免疫印迹法评估不同组小鼠肝组织中PPARα和SREBP1c的蛋白表达。F采用定量聚合酶链反应(qPCR)(n=3)定量肝组织中CPT1α和FcB的mRNA水平。通过免疫印迹法在不同组小鼠的肝组织中评估CPT1α、AMPK和磷酸化AMPK(p-AMPK)蛋白的蛋白表达。
实验结束后,细胞用油红O和尼罗红染色。结果显示,OA和PA处理的细胞显示尼罗红荧光强度和油红O面积增加,而与外来体共孵育后,这一现象得到显著改善(图1C、D)。细胞内活性氧(ROS)的含量在一定程度上可以反映细胞损伤的程度。ROS荧光探针染色结果显示,OA/LPS作用后细胞ROS荧光强度明显增强,与对照组比较差异有显著性(P<0.05)。
PA诱导和与外来体共孵育可逆转这一现象(图1B)。最后,检测肝脂代谢相关基因在细胞中的表达情况。外泌体促进了脂肪酸氧化基因PPARα和CPT1α的mRNA表达水平,并降低了脂质合成基因SREBP1c和FASN的mRNA表达水平(图1E、F)。Western blot结果显示,与exosome共孵育后,细胞内AMPK蛋白磷酸化水平升高,肝脏PPARα和CPT1α蛋白表达显著升高,而SREBP1c蛋白表达降低(图1E、F)。这些结果与体内试验一致。
小编有话说:
本文采用250μmol/L棕榈酸钠溶液联合500μmol/L油酸钠的游离脂肪酸(FFAs)溶液处理HepG2细胞24小时,成功建立HepG2细胞高脂细胞模型(非酒精性脂肪性肝细胞模型),成功诱导细胞内脂质积累、脂肪形成、氧化应激以及脂质积累引起的线粒体损伤,包括ROS产生、线粒体膜电位异常和ATP紊乱等,基于该模型用药,验证了来源于顶乳头干细胞(SCAPs)的外泌体能够通过调节脂肪酸代谢和减少炎症改善NASH。
参考文献
Yifei Nie, Wenqing Meng, Duanqin Liu, et al. Exosomes derived from apical papilla stem cells improve NASH by regulating fatty acid metabolism and reducing inflammation [J]. Molecular Medicine, 2024.



