Huh 7、HepG2、AML 12、原代肝细胞高脂细胞模型建立方法(细胞脂毒性模型)
本文采用300μmol/L棕榈酸钠溶液(货号KC001)处理原代肝细胞,两种人肝细胞系-Huh7和HepG2以及小鼠肝细胞系-AML12,36小时后,成功建立肝细胞高脂细胞模型(细胞脂毒性模型),基于该模型添加他莫昔芬(10、20、40μM),实验数据共同表明他莫昔芬可以有效地保护肝细胞免受体外脂毒性,而不增加细胞毒性,并以JNK/MAPK信号传导依赖性方式改善NAFLD。如果联合使用油酸钠来诱导NAFLD细胞模型,一般建议采用的浓度比为油酸钠:棕榈酸钠=2:1(货号KC006),处理时间2-3天,效果会更好、且更加稳定。
Huh 7、HepG2、AML 12、原代肝细胞高脂细胞模型建立方法(细胞脂毒性模型)
Signal Transduction and Targeted Therapy(IF= 40.8)
1. 前言
非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)是一种代谢相关的慢性肝脏疾病,在西方国家已成为肝细胞癌的主要病因和肝移植的主要原因。在病理学特征方面,NAFLD可分为非酒精性脂肪肝和非酒精性脂肪性肝炎(NASH),NASH易发生终末期脂肪肝。NAFLD的发病机制复杂,与肥胖、2型糖尿病、高脂血症和代谢综合征密切相关。尽管疾病负担在增加,但迄今为止尚未发现FDA批准的药物可有效治疗NAFLD或NASH。
他莫昔芬于1966年合成,是一种选择性雌激素受体(ER)调节剂(SERM)。一些体外和体内实验证明,他莫昔芬促进肝细胞中的脂质积累并增强脂肪酸生物合成。然而,一些其他发现表明,他莫昔芬保护肝细胞免受脂毒性和脂肪变性。为了探索他莫昔芬对肝细胞的影响,本文利用原代肝细胞,两种人肝细胞系-Huh 7和HepG 2以及小鼠肝细胞系-AML 12构建体外高脂细胞模型,以验证他莫昔芬以JNK/MAPK信号传导依赖性方式改善NAFLD。
2. 游离脂肪酸FFAs
游离脂肪酸FFAs为西安鲲创科技发展有限公司(Kunchuang Biotechnology,Xi’an,China)的高脂细胞添加剂(棕榈酸钠)(货号KC001),高脂细胞添加剂为液体即用型,具有溶剂无毒、常温无析出、浓度精准,无需多次加热助溶等特点。实际使用时,只需要将试剂按照比例加入到完全培养基中即可。

3. 细胞培养
细胞系获自中国科学院细胞库(中国上海)。Huh7和HepG2细胞系在补充有10%胎牛血清(FBS)和100U/ml青霉素和0.1mg/ml链霉素或高葡萄糖DMEM培养基中生长。使AML12细胞系在补充有10% FBS、1% ITS液体培养基补充物和40ng/ml地塞米松的DMEM:F12培养基中生长。
将所有细胞系保持在37°C和5% CO2的加湿培养箱中。在每个实验中使用第三代至第十代的细胞。从8周龄雄性C57BL/6小鼠中分离原代肝细胞,并在HM培养基中培养,然后以1×106/孔接种在6孔板中。为了诱导细胞脂毒性,将0.3mM棕榈酸钠溶液(KC001,Kunchuang Biotechnology,Xi'an,China)加入培养基中,并加入载体作为对照。36h后,以10、20、40μM的剂量加入溶于DMSO的他莫昔芬并保持36h,加入DMSO作为对照。为了在体外诱导JNK活化,在他莫昔芬处理前2小时加入茴香霉素(10μM)。
为了在体外抑制JNK磷酸化,在他莫昔芬处理前2小时加入30μM Tanzisertib(cc-930)。对于细胞油红O(ORO)染色,将细胞在六孔板中培养,并在棕榈酸钠和他莫昔芬处理后,除去培养基,并用4%多聚甲醛固定细胞30分钟,并用PBS洗涤三次。然后用60%异丙醇处理细胞5min。去除异丙醇,用ORO工作液染色细胞10分钟,并用PBS洗涤细胞。然后将细胞用苏木精染色3-5分钟,并用PBS洗涤至少三次。然后,我们使用倒置相差显微镜观察并拍照。对于细胞TC和TG测试,采用商业试剂盒并遵循制造商的说明。
4. 细胞处理与结果
为了诱导脂毒性,将细胞暴露于0.3 mM棕榈酸钠溶液36 h。处理时,在细胞培养基中加入不同浓度的他莫昔芬(10、20、40 μM),继续培养36 h。如油红O(ORO)染色所示(图1a,B),在原代肝细胞和所有三种细胞系中,他莫昔芬可以剂量依赖性方式显著降低棕榈酸钠触发的脂质蓄积。然而,他莫昔芬处理没有降低细胞的TC含量,也没有改变HepG 2细胞系的TG含量。
为了研究他莫昔芬是否增加细胞毒性,我们在用PA加不同浓度的TAM处理的Huh 7和AML 12细胞系中进行染色,以检查细胞活力,发现他莫昔芬处理不增加细胞毒性(补充图S1 a,B)。为了研究他莫昔芬对脂质代谢的作用,我们进行了RT-qPCR实验,发现他莫昔芬以剂量依赖性方式抑制了与脂质摄取(FATP 2、FATP 5和CD 36)、新生脂肪生成(SREBP 1c、FAT 3、SCD 1和ACC 1)、脂肪酸氧化(PPARα、CPT 1 α和ACOX 1)和TG输出(APOB和MTTP)相关的基因表达(补充图S1 c)。这些数据共同表明,他莫昔芬可以有效地保护肝细胞免受体外脂毒性,而不增加细胞毒性。
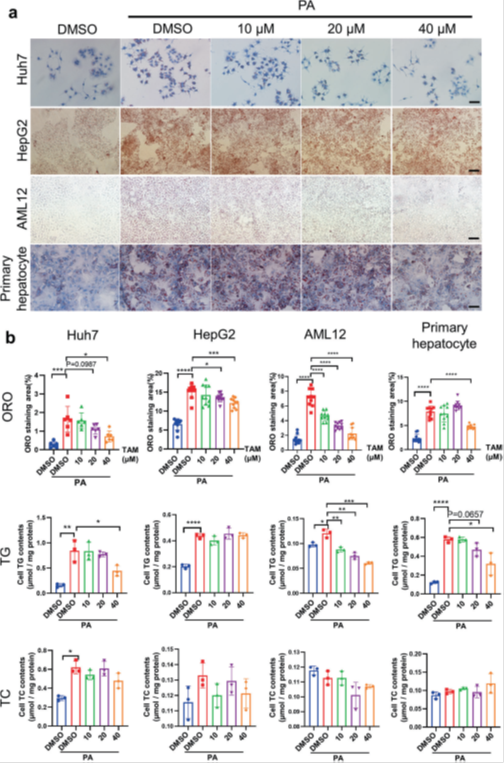
图1他莫昔芬降低体外肝细胞脂毒性。a将Huh7、HepG2、AML12细胞和原代肝细胞接种在六孔板中。12小时后,向培养基中加入0.3mM棕榈酸钠,36小时后,加入DMSO/他莫昔芬(10、20、40μM)。36小时后,将细胞用ORO染色,使用倒置相差显微镜拍照,并通过ORO染色面积定量。刻度条:100μm。BORO染色的统计分析。对于细胞TC和TG测试,用胰蛋白酶消化细胞,用PBS洗涤并使用离心机收集。根据制造商的方案进行以下步骤。所有实验重复至少三次生物学时间。
实际操作时,建议待细胞生长至80-100%汇合度时,换成新鲜的含血清、含双抗(10% FBS、1% P/S)的完全培养基,按上述浓度滴加高脂细胞添加剂,对照组加入等量溶剂对照,试剂轻柔地加入到细胞培养皿中,避免局部高浓度试剂损伤细胞,混匀后将细胞放入细胞孵箱中继续培养。此外,上述作用浓度可能会因加药时的细胞密度、代数、状态或耐药性的不同而有所区别。因此,建议具体实验中,先通过浓度、时间梯度实验,寻找出适合于所用细胞的最佳药物作用浓度和最佳作用时间,一般建议作用48-72小时。
小编有话说:
本文采用300μmol/L棕榈酸钠溶液(货号KC001)处理原代肝细胞,两种人肝细胞系-Huh7和HepG2以及小鼠肝细胞系-AML12,36小时后,成功建立肝细胞高脂细胞模型(细胞脂毒性模型),基于该模型添加他莫昔芬(10、20、40μM),实验数据共同表明他莫昔芬可以有效地保护肝细胞免受体外脂毒性,而不增加细胞毒性,并以JNK/MAPK信号传导依赖性方式改善NAFLD。如果联合使用油酸钠来诱导NAFLD细胞模型,一般建议采用的浓度比为油酸钠:棕榈酸钠=2:1(货号KC006),处理时间2-3天,效果会更好、且更加稳定。
参考文献
Zhiqiang Fang, Hao Xu, Juanli Duan, et al. Short-term tamoxifen administration improves hepatic steatosis and glucose intolerance through JNK/MAPK in mice [J]. Signal Transduction and Targeted Therapy.



