IF/7.5:高糖高脂刺激H9c2心肌细胞模拟DCM(糖尿病心肌病)微环境
H9c2心肌细胞暴露于HG/HF(25mM葡萄糖+300μM棕榈酸)模拟DCM微环境
H9c2心肌细胞暴露于HG/HF(25mM葡萄糖+300μM棕榈酸)模拟DCM微环境,通过JC-1检测线粒体膜电位、PI/Hoechst染色量化焦亡率、Westernblot分析MITOL/STING/GSDMD-N蛋白表达,并分别采用siRNA敲低MITOL、药物调控STING活性,验证鸢尾素通过MITOL抑制STING依赖性焦亡的机制。
1. 前言
糖尿病心肌病(DCM)是糖尿病的主要并发症,以心脏结构异常、代谢紊乱和心功能进行性下降为特征,其核心机制涉及线粒体功能障碍与炎症反应激活。近年研究发现,cGAS-STING通路通过感知胞质DNA(如线粒体DNA泄漏)触发炎症级联反应,进而激活NLRP3炎性体及下游焦亡蛋白GSDMD,导致心肌细胞焦亡——一种伴随膜破裂和IL-1β释放的程序性死亡形式,直接加剧DCM的心肌纤维化与重构。鸢尾素(Irisin)作为运动诱导的肌源性因子,可通过上调线粒体泛素连接酶MITOL改善线粒体稳态,但其是否通过调控cGAS-STING-GSDMD轴抑制焦亡来缓解DCM尚不明确。
研究结合高脂饮食/链脲佐菌素诱导的DCM小鼠模型及棕榈酸/高糖(HG/HF)处理的H9c2细胞模型,通过干预鸢尾素、MITOL过表达腺病毒、STING抑制剂(C-176)及激活剂(diABZI),系统评估心脏功能、焦亡标志物及MITOL/STING通路活性。
H9c2心肌细胞暴露于HG/HF(25mM葡萄糖+300μM棕榈酸)模拟DCM微环境,通过JC-1检测线粒体膜电位、PI/Hoechst染色量化焦亡率、Westernblot分析MITOL/STING/GSDMD-N蛋白表达,并分别采用siRNA敲低MITOL、药物调控STING活性,验证鸢尾素通过MITOL抑制STING依赖性焦亡的机制。
2. 高脂细胞添加剂
文中采用棕榈酸钠作为高脂细胞添加剂(现货号KC001,原货号SYSJ001,Kunchuang Biotechnology)处理细胞。同时采用葡萄糖作为高糖细胞添加剂配合棕榈酸钠,模拟高糖高脂的糖尿病心肌病微环境。

该试剂(KC001)包括了5ml、6mmol/L无菌包装的棕榈酸钠和5ml的溶剂对照,能够直接使用,具备溶剂无毒、常温无析出,无需加热助溶等优点,显著减少操作步骤,提升实验的稳定性。其中,棕榈酸(钠)主要诱导细胞损伤和炎症反应。此外,还可以直接使用即用型高糖高脂试剂盒(货号KT001),包含独立包装的葡萄糖、甘露醇、棕榈酸钠以及高脂溶剂对照,提升实验效率。
3.细胞处理及部分实验结果
1)HG/HF诱导心肌细胞焦亡及鸢尾素的保护作用
在棕榈酸钠/高糖刺激下,H9c2细胞呈现典型焦亡特征:PI阳性细胞率显著升高(图1c-d,红色荧光标记焦亡核,DAPI标记总核),同时线粒体膜电位(JC-1聚合体/单体比值)下降,表明线粒体损伤驱动细胞死亡。Westernblot结果(图1a-b)显示HG/HF组GSDMD-N片段、cGAS、STING、NLRP3及IL-1β蛋白表达均上调,证实cGAS-STING通路激活及焦亡执行。而鸢尾素预处理可显著逆转上述现象:PI阳性率降低约40%,JC-1比值恢复,且GSDMD-N和STING蛋白水平下降(图1d,4d),说明鸢尾素通过维持线粒体功能抑制焦亡。

图1 鸢尾素对HG/HF处理中H9c2细胞的影响
2)MITOL的核心调控地位
鸢尾素对HG/HF损伤的保护作用依赖MITOL表达。如图2a-b所示,鸢尾素处理使MITOL蛋白水平提升2.1倍,但敲低MITOL(siRNA)后,其抗焦亡效应被完全消除:JC-1聚合体/单体比值再度下降(图2c-d,绿色单体荧光增强),PI阳性细胞率反弹至HG/HF水平(图2e-f),且STING和GSDMD-N蛋白表达回升。这表明MITOL是鸢尾素下游的关键效应分子,通过负调控STING通路抑制焦亡。
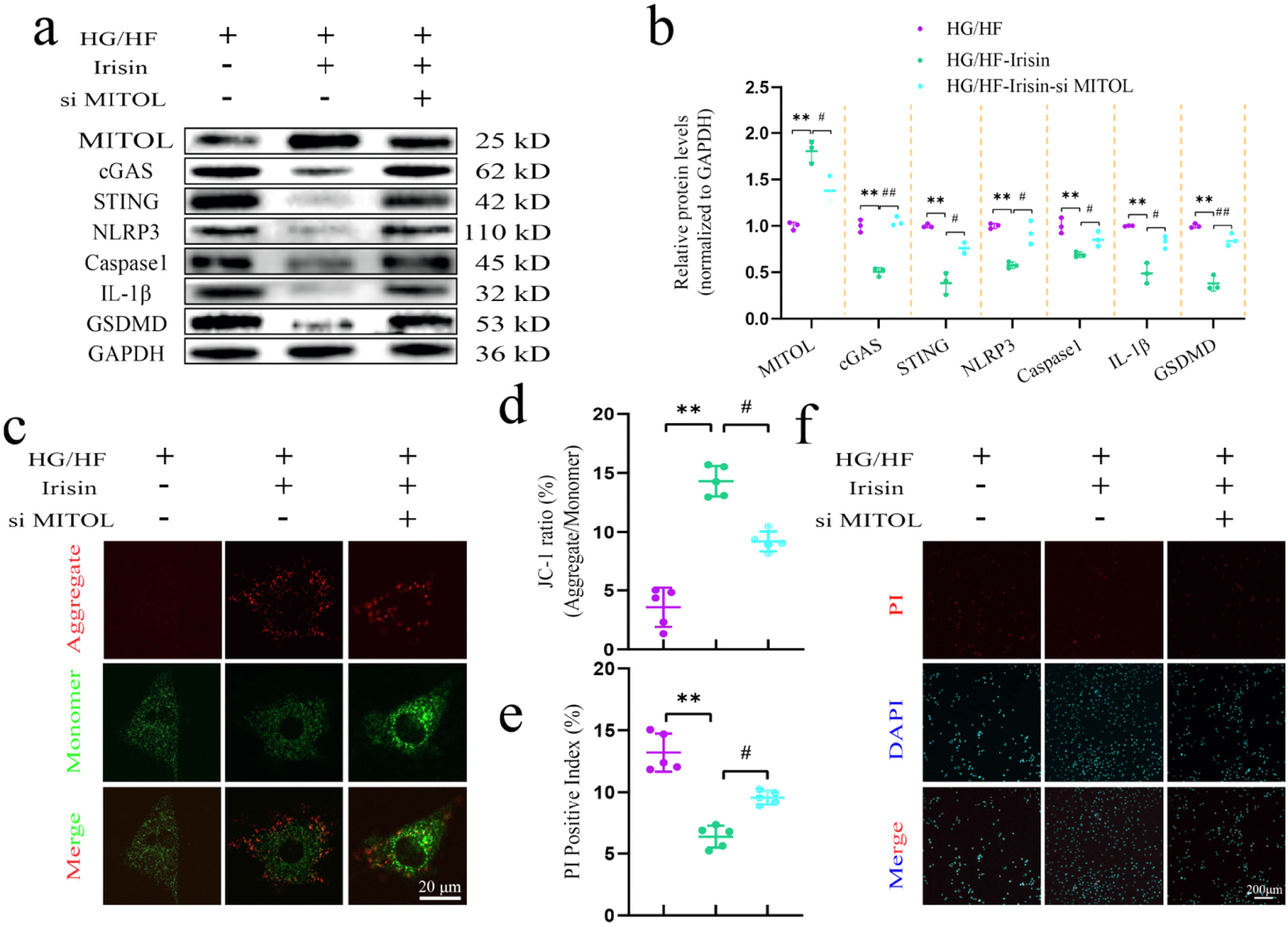
图2 MITOL抑制HG/HF联合或不联合Irisin处理对H9c2细胞的影响
3)STING通路的双向调控验证
为明确STING在MITOL下游的作用,研究使用STING激活剂diABZI处理鸢尾素保护的H9c2细胞。如图3所示,diABZI可抵消鸢尾素对线粒体的保护(JC-1比值回落,图3c-d)并逆转焦亡抑制(PI阳性率升高,图3e-f),且Westernblot中STING和GSDMD-N蛋白再度升高(图3a-b),但MITOL表达不变,证实STING是MITOL下游的独立作用靶点。反之,在MITOL敲低细胞中施加STING抑制剂C176,可部分恢复线粒体膜电位(JC-1聚合体增加)并减少PI阳性细胞,说明抑制STING能挽救MITOL缺失导致的细胞损伤。

图3 diABZI对HG/HF联合或不联合Irisin处理的H9c2细胞的影响
4)细胞实验与动物模型的一致性
细胞层面结论与小鼠心脏组织结果相互印证:DCM心肌中STING和GSDMD-N蛋白高表达,鸢尾素或Ad-MITOL干预后显著降低;而STING抑制剂C176虽不影响MITOL表达,但同样抑制焦亡并改善心功能,进一步支持"MITOL→STING→GSDMD焦亡轴"的普适性机制。
4.总结
糖尿病性心肌病(DCM)是糖尿病(DM)的常见并发症。然而,DCM诱导心脏损伤的潜在机制仍不清楚.近年来,环化GMP-AMP合酶/干扰素基因刺激因子(cGAS/STING)信号通路与肥厚在DCM发病中的作用已有研究。基于我们先前的研究结果,本研究旨在研究马蔺子素、线粒体泛素连接酶(MITOL/MARCH 5)和cGAS/STING信号通路在DCM诱导的心功能不全中的作用以及gasdermin D(GSDMD)依赖性眼球下垂的作用。在实验结束时,使用高脂饮食诱导的小鼠和H9c2细胞进行心脏几何形状和功能或与心脏病相关的生物标志物评估。在此,我们发现DCM通过增加心脏纤维化和GSDMD依赖性睑下垂损害心脏功能,包括激活MITOL和cGAS/STING信号传导。我们的结果证实马蔺素和MITOL的保护作用被cGAS/STING信号通路的激活部分抵消。我们还证实了GSDMD依赖性睑下垂在DCM发病的病理过程中起着关键作用。我们的结果表明,鸢尾素治疗通过上调MITOL来保护DCM损伤、线粒体稳态和血小板减少。
小编有话说:
棕榈酸钠(300μM)作为高脂刺激的核心试剂能够成功模拟DCM的脂毒性微环境,诱导线粒体膜电位崩溃(JC-1绿/红比↑)及GSDMD依赖性焦亡(PI+细胞率↑~3倍),且同步激活cGAS-STING通路(STING蛋白↑1.8倍)。
该模型高度依赖棕榈酸的批次稳定性与溶解度,高脂细胞添加剂(KC001)提供的钠盐制剂经严格质控,脂质纯度高(>99%)、低内毒素(<0.1EU/mg),确保实验可重复性。其应用覆盖心肌细胞、肝细胞、胰岛β细胞等多种代谢疾病模型,可精准模拟脂质堆积引发的线粒体损伤-炎症级联反应。未来研究可进一步结合该试剂探索脂毒性心肌病的药物靶点,推动DCM干预策略的临床转化。
参考文献
Irisin improves diabetic cardiomyopathy-induced cardiac remodeling by regulating GSDMD-mediated pyroptosis through MITOL/STING signaling [J], Biomedicine & Pharmacotherapy.



