棕榈酸(钠)模拟高脂环境刺激脂肪组织巨噬细胞(ATMs)与脂肪源性干细胞(ADSCs)
利用棕榈酸(钠)模拟高脂环境刺激脂肪组织巨噬细胞(ATMs)与脂肪源性干细胞(ADSCs),以揭示ADSCs与ATMs互作致脂肪组织炎症的新机制。
为了探究ADSCs和ATMs经由TNTs的线粒体转运模式,以及该转运模式对ATMs代谢模式和表型转变的影响,并探索相关调控的分子机制,利用棕榈酸(钠)模拟高脂环境刺激脂肪组织巨噬细胞(ATMs)与脂肪源性干细胞(ADSCs),以揭示ADSCs与ATMs互作致脂肪组织炎症的新机制。
棕榈酸(钠)模拟高脂环境刺激脂肪组织巨噬细胞(ATMs)与脂肪源性干细胞(ADSCs)
重庆医科大学/博士论文
1. 前言
妊娠期糖尿病(Gestational diabetes mellitus, GDM)是指在妊娠期间首次发生的糖耐量受损,与妊娠期高血压、早产等多种妊娠不良结局相关。GDM作为妊娠期最为常见的代谢性疾病,阐明其发病机制意义重大。胰岛素抵抗是GDM的基本病理生理改变,在GDM发病进程中起到了重要作用。而作为发生胰岛素抵抗的主要场所之一,脂肪组织发生功能异常是GDM的关键性早期事件。
在病理状态下,脂肪组织巨噬细胞(Adipose tissue macrophages, ATMs)向促炎表型分化比例增加,使脂肪组织形成慢性低度炎症环境,是脂肪组织发生胰岛素抵抗的重要原因。ATMs内部的线粒体含量改变会导致细胞发生代谢重塑并产生能量代谢的变化,这与ATMs的表型转变及功能密切相关。隧道纳米管(Tunneling Nanotubes, TNTs)是一种连接两个细胞的通道式膜结构,可以实现细胞间线粒体的快速转运,主要形成于间充质干细胞、免疫细胞及肿瘤细胞。而脂肪源性干细胞(Adipose-derived stem cell, ADSCs)与ATMs是脂肪组织中占主导地位的间充质干细胞和免疫细胞。
为了探究ADSCs和ATMs经由TNTs的线粒体转运模式,以及该转运模式对ATMs代谢模式和表型转变的影响,并探索相关调控的分子机制,利用棕榈酸(钠)模拟高脂环境刺激脂肪组织巨噬细胞(ATMs)与脂肪源性干细胞(ADSCs),以揭示ADSCs与ATMs互作致脂肪组织炎症的新机制。
2.实验材料
本文采用棕榈酸钠高脂细胞添加剂(KC002,Xi'an Kunchuang Technology, China)作为游离脂肪酸(free fatty acids,FFAs),完成体外细胞实验。采用可靠的高脂细胞添加剂,能够保证溶剂无毒、无菌、常温无析出、低温无析出、浓度精准,而且无需多次加热助溶,显著减少了操作步骤,提升了实验的稳定性。实际使用时,只需要将高脂细胞添加剂按照比例加入到完全培养基中即可。

3. 实验方法
1)小鼠原代脂肪源性干细胞的提取
(1)选取10-12周正常C57BL/6J雌性小鼠,脱颈法处死。将处死后小鼠固定于解剖台上,用75%酒精充分消毒。(2)用无菌组织剪和无菌镊子打开小鼠腹腔,取出大网膜脂肪组织,用含1%青霉素-链霉素溶液的PBS清洗2-3次。(3)提取SVF。(4)将SVF用DMEM/F12完全培养基重悬,铺板于6cm细胞培养皿中,于37℃ 5%CO2细胞培养箱中培养,定期换液,待细胞融合度达到90%左右进行传代,传代2-3次后即可得到原代脂肪源性干细胞(ADSCs)(5)通过流式细胞仪鉴定ADSCs,CD14-CD45-CD90+CD44+的细胞被认为是ADSCs。
2)小鼠原代脂肪组织巨噬细胞的提取
(1)提取小鼠大网膜脂肪组织SVF。随后通过磁珠分选(MACS)提取小鼠原代脂肪组织巨噬细胞(ATMs)。(2)将MACSBSA储存液和autoMACS冲洗液按1:20比例混合配置成MACS缓冲液。(3)用80μl MACS缓冲液重悬SVF,加入20μl抗F4/80微珠,混匀,4℃避光孵育15min。(4)用1ml MACS缓冲液洗涤细胞,300g离心10min,弃上清。500μl MACS缓冲液重悬。(5)将MACS分选架、LS分选柱、分选器进行组装,向分选柱中加入3mlMACS缓冲液润洗,等待缓冲液即将流空时,少量多次加入孵育后的细胞样本,在分选柱下方放置15ml离心管,收集F4/80阴性细胞。(6)待缓冲液即将流空时,向分选柱中加入3mlMACS缓冲液,重复3次,收集全部F4/80阴性细胞。(7)待分选柱中液体彻底流完,将分选柱放入5ml无菌离心管,加3mlMACS缓冲液于分选柱中,安装活塞并迅速推动,从而收集F4/80阳性细胞,即为ATMs。(8)将收集到的ATMs置于6cm细胞培养皿中,用RPMI1640完全培养基于37℃5% CO2细胞培养箱中培养,用于后续实验。
3)不同高脂高糖条件下细胞间线粒体转运效率检测
(1)将适宜密度的小鼠原代ADSCs和ATMs细胞共培养,将ADSCs铺板于12孔细胞培养板,将ATMs铺板于Transwell小室,随后将Transwell小室置于12孔板顶部,从而实现ADSCs和ATMs的分隔培养。
(2)根据组别不同,分别向共培养细胞中加入棕榈酸钠(终浓度0.3mmol/L)、D-葡萄糖(终浓度22.5mmol/L)、D-甘露醇(终浓度22.5mmol/L)。
(3)根据加入试剂以及培养模式的不同,分为以下10个组别:
CellTrace™Violet标记ADSCs+MitoTracker™RedCMXRos标记ATMs:①对照组,②高脂组(加棕榈酸钠),③高糖组(加D-葡萄糖),④高糖对照组(加D-甘露醇),⑤Transwell小室间隔培养组;
MitoTracker™RedCMXRos标记ADSCs+CellTrace™Violet标记ATMs:①对照组,②高脂组(加棕榈酸钠),③高糖组(加D-葡萄糖),④高糖对照组(加D-甘露醇),⑤Transwell小室间隔培养组。
(4)所有组别均在37℃ 5% CO2细胞培养箱中培养16h。消化并收集细胞,立即进行流式细胞仪上机检测。
4)巨噬细胞表型检测及炎症因子水平测定
(1)将提取的原代ATMs及ADSCs铺板于12孔细胞培养板中。根据培养方式不同,将细胞分为4组,所有组别均培养16h:
①单独培养组(Monoculture):ATMs单独培养;
②高脂组(Monoculture+PA):在ATMs单独培养的基础上,添加0.3mmol/L的棕榈酸钠。
③共培养+棕榈酸钠组(Coculture+PA):ATMs与ADSCs共同培养并添加0.3mmol/L的棕榈酸钠;
④Transwell小室间隔培养+棕榈酸钠组(Transwellculture+PA):将ATMs和ADSCs分别培养于Transwell小室的上下层并添加0.3mmol/L的棕榈酸钠;
(2)收集各组细胞并进行流式染色。采用MACS方法分离共培养细胞。采用PEanti-mouseCD86抗体、FITCanti-mouseCD206抗体、APCanti-mouseF4/80抗体对ATMs进行染色,F4/80+细胞被鉴定为巨噬细胞,其中CD86+CD206-细胞被鉴定为促炎表型,CD86-CD206+被鉴定为抑炎表型
(3)收集各组培养基进行炎症因子水平测定。
4.实验结果分析
1)高脂及高糖状态抑制线粒体转运
高血脂和血糖水平是GDM患者常见的两大特征,为了探究高脂和高糖状态是否会对ADSCs和ATMs间的线粒体转运产生影响,在ADSCs和ATMs共培养系统中添加过量的棕榈酸钠(PA)或葡萄糖以模拟高脂或高糖状态,并用添加了甘露醇的等渗培养基作为对照,每组实验重复3次。按照与前述相同的细胞标记方法,通过流式细胞术检测,发现高脂和高糖状态均不同程度抑制了ADSCs和ATMs之间的线粒体转运,高脂组的抑制作用尤甚(图1)。
此外,将ADSCs和ATMs分别培养在Transwell小室的上层和下层中,以阻断两种细胞间TNTs的形成,同时不影响细胞间其他形式的分子传递。结果发现与常规共培养组相比,Transwell组中ADSCs和ATMs之间的线粒体转运比例大大降低(图1),这说明TNTs结构是ADSCs与ATMs间线粒体转运的主要途径。
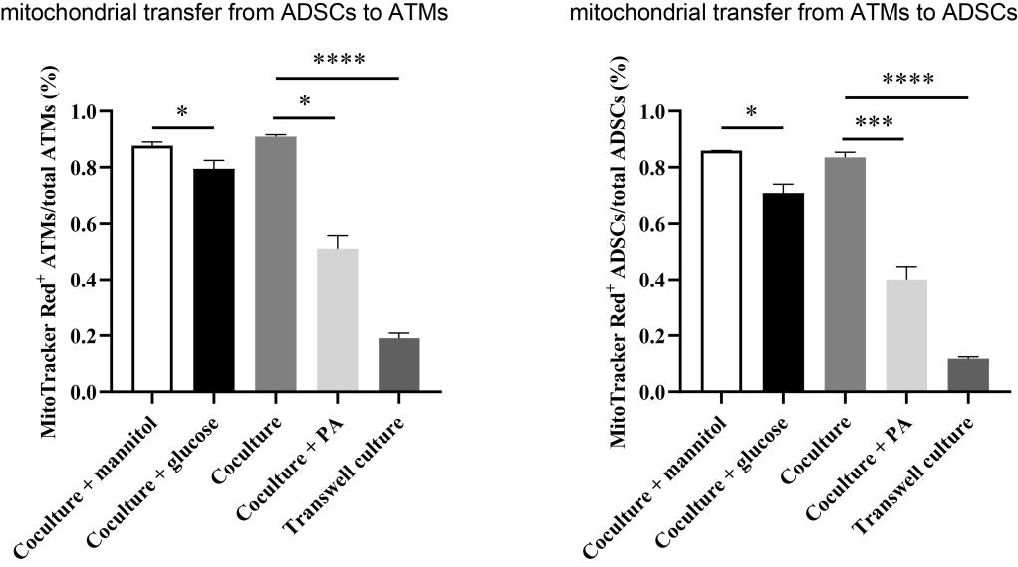
图1 不同条件下ATMs与ADSCs之间的线粒体转运效率
2)线粒体转运受阻造成ATMs更易向促炎表型分化及炎症因子水平升高
能量代谢状态的改变很可能会影响巨噬细胞的表型以及功能。为了探究线粒体转运对ATMs表型的影响,我们通过添加棕榈酸钠(PA)以诱导ATMs向促炎表型分化,并检测促炎ATMs(CD86+CD206-)比例。根据不同培养条件以及是否添加PA,将ATMs分为单独培养组(对照组)、单独培养+PA组、共培养+PA组以及Transwell培养+PA组,每组实验重复3次。通过流式细胞术,我们发现与单独培养组相比,单独培养+PA组中促炎ATMs(CD86+CD206-)比例出现了明显升高;而相较于单独培养+PA组而言,共培养+PA组中促炎ATMs比例显著降低(图2),即共培养的方式显著抑制了PA所导致的ATMs促炎表型分化。Transwell培养+PA组的促炎ATMs比例显著高于共培养+PA组(图2)。此外,各组细胞培养基中的炎症因子水平也与促炎细胞比例趋势相同(图2)。以上结果说明线粒体的转运可以抑制ATMs的促炎分化倾向,通过Transwell使经由TNTs的线粒体转运受阻会加剧ATMs向促炎表型分化以及炎症因子的产生。
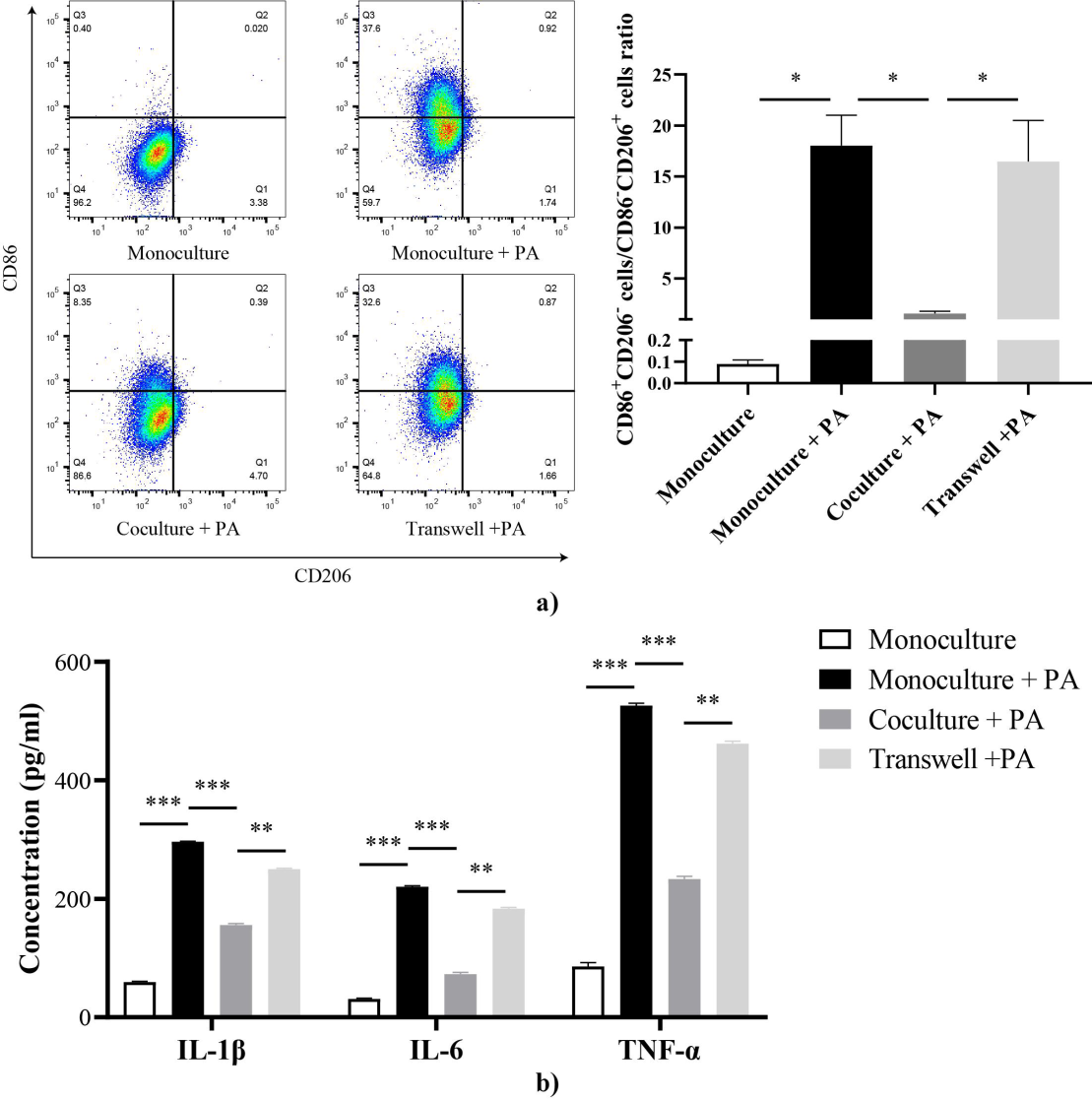
图2 不同培养条件下ATMs表型比例及炎症因子水平。a)不同培养条件下促炎ATMs(CD86+CD206-)与抑炎ATMs(CD86-CD206+)ATMs比例。b)不同培养条件下培养基中炎症因子浓度。
小编有话说:
本文采用300μM棕榈酸钠、16h刺激脂肪组织巨噬细胞(ATMs)与脂肪源性干细胞(ADSCs)模拟肥胖患者体内高糖高脂环境,体外细胞实验表明棕榈酸(钠)形成的高脂环境抑制了ATMs与ADSCs之间的线粒体转运,经由TNTs获取线粒体后,ATMs的基础呼吸速率、最大呼吸速率以及ATP产生效率升高;经由TNTs的线粒体转运受阻导致了棕榈酸钠刺激下的ATMs促炎表型比例增加、炎症因子水平升高、线粒体膜电位下降以及吞噬能力减弱。
上述实验条件和结果,可能会因加药时的细胞密度、代数、状态或耐药性的不同而有所区别。因此,建议具体实验中,先通过浓度、时间梯度实验,寻找出适合于所用细胞的最佳药物作用浓度和最佳作用时间,一般建议在200-500 umol/L范围内、作用24-48小时。
参考文献
陈炳南. 在妊娠期糖尿病中巨噬细胞与脂肪源性干细胞通过隧 道纳米管转运线粒体的机制研究[D],博士论文,2024(5).



