CDD:高脂细胞添加剂-棕榈酸(PA)和油酸(OA)诱导小鼠原代肝细胞、HepG2细胞脂质沉积及脂毒性模型的经验分享
作者采用0.25 mM的棕榈酸(PA)溶液联合0.5 mM的油酸(OA)溶液处理细胞48小时以诱导细胞脂质沉积、建立细胞脂毒性模型
在建立小鼠原代肝细胞、HepG2细胞脂质沉积和脂毒性模型中,上述实验条件和结果,可能会因加药时的细胞密度、代数、状态或耐药性的不同而有所区别。因此,建议具体实验中,先通过浓度、时间梯度实验,寻找出适合于所用细胞的最佳药物作用浓度和最佳作用时间。
CDD:棕榈酸(PA)和油酸(OA)诱导小鼠原代肝细胞、HepG2细胞脂质沉积及脂毒性模型的经验分享
Cell Death & Disease[2023](IF=8.1)
1. 前言
甘油三酯(TGs)在能量过剩时以中性脂质的形式储存能量,并在能量不足时作为能量储备。磷脂酰乙醇胺(PE)是哺乳动物体内第二丰富的磷脂,为细胞膜提供关键的结构支持,并有助于膜蛋白的形成和稳定。最近的研究表明,PE的减少伴随着TG的积累,导致了一系列代谢性疾病的加重。为此,甘油三酯的合成、分解代谢和转化影响着许多对脂质稳态至关重要的细胞过程,促使我们探索脂质稳态与肥胖治疗之间的复杂关系。
甘油三酯通过脂肪甘油三酯脂肪酶(ATGL)和激素敏感脂肪酶(HSL)依次分解为甘油二酯(DG)、单酰甘油和游离脂肪酸(FFAs)。FFAs是能量供应和产热所必需的物质。在健康的脂质稳态中,循环中的FFA供应与线粒体的氧化代谢能力精确匹配。然而,增强的脂肪分解活性会释放出有毒的FFAs,从而引起细胞脂肪毒性。作为TGs的二级分解产物,DGs是肯尼迪途径中磷脂合成的直接前体,而肯尼迪途径是哺乳动物细胞中PE合成的主要途径。在乙醇胺磷酸转移酶1(EPT1)的催化下,CDP-乙醇胺中的磷乙醇胺转移至DG,从而合成PE。因此,我们推测将TG分解产物转入PE合成可以解决活性脂解引起的脂肪毒性问题。
本研究旨在探讨通过LXRα-ATGL/EPT1轴恢复TG和PE之间的脂质稳态是否在缓解脂肪变性和脂肪毒性方面起着关键作用。脂质组学数据显示,肥胖会导致体内 TG 和 PE 的紊乱。机制研究发现,LXRα缺失导致TG代谢酶ATGL和磷脂合成酶EPT1的减少,是导致TG和PE失衡的主要分子机制。此外,通过补充适量的 PE 或使用 LXRα 的天然激动剂(冬凌草甲素),可减少 TG 的积累和脂肪毒性。这些观察结果表明,LXRα-ATGL/ EPT1 轴在 TG 和 PE 之间的协调中起着至关重要的作用。恢复 TG 和 PE 中的脂质稳态可能有助于改善肝脂肪变性。这些观点为治疗因过量脂肪摄入而诱发的代谢性疾病提供了新的思路。
2.体外细胞模型构建方法
油酸(OA)和棕榈酸(PA)是脂肪肝血清中含量最丰富的游离脂肪酸,是动物食品中不可缺少的油脂组成,OA和PA在日常膳食中均以浓度摩尔比2∶1存在,在肥肝的发生和发展中有重要作用。研究表明,OA和PA不仅可以诱导细胞内脂质沉积,使细胞发生变性,还可以增强大鼠大脑的氧化损伤,并诱导细胞产生氧化应激。
因此,作者采用0.25 mM的棕榈酸(PA)溶液联合0.5 mM的油酸(OA)溶液处理细胞48小时以诱导细胞脂质沉积、建立细胞脂毒性模型。本文中油酸、棕榈酸等游离脂肪酸均源自西安鲲创科技发展有限公司(Xi'an Kunchuang Technology Development Co., Ltd)(现货号KC006、旧货号SYSJ-KJ006)。采用可靠的高脂细胞添加剂,能够保证溶剂无毒、无菌、常温无析出、低温无析出、浓度精准,而且无需多次加热助溶,显著减少了操作步骤,提升了实验的稳定性。实际使用时,只需要将高脂细胞添加剂按照比例加入到完全培养基中即可。

3.实验结果
1)促进TG水解和补充PE可改善LXRα-/-小鼠原代肝细胞中的脂质沉积和脂毒性
当他汀类或贝特类药物用于降低血脂以治疗心血管疾病时,据报道,肌痛、糖尿病和肝转氨酶升高的风险增加。我们的研究发现,在肥胖导致的脂质紊乱中,PE会下降。为此,我们想知道在常规降脂药物治疗中额外补充PE是否可以减轻脂毒性。在此,从LXRα-/-小鼠中提取的原代肝细胞用棕榈酸(PA)(0.25 mM)和油酸(OA)(0.5 mM)处理48 h,以诱导脂质沉积。在PA和OA存在下,再用不同浓度的PE同时处理这些细胞。我们监测到OA和PA刺激能够显著降低细胞活力(图1A)。5 μM PE处理可使细胞活力增加17%,10 μM可使细胞活力增加21%(补充图S8)。油红O(ORO)染色显示,阿托伐他汀和苯扎贝特显著降低了细胞脂质积累,而PE联合治疗并未降低其降脂作用(图1A)。当直接检测、定量TG含量和尼罗红(NR)荧光强度时,获得了类似的结果(图1B,D)。CCK 8测定表明,当阿托伐他汀和苯扎贝特处理不能恢复正常细胞活力时,10 μM PE联合处理可以显著提高细胞活力(图1C)。NR染色和DAPI染色的结合可进一步验证上述结果。NR染色显示阿托伐他汀和苯扎贝特的降脂作用(图1E)。此外,在阿托伐他汀或苯扎贝特处理后仍观察到凋亡细胞的核形态学变化,但在与10 μM PE联合处理后消失(图1E)。总之,我们证明单独的降脂治疗不能改善脂毒性,如细胞凋亡。适度PE治疗可通过保护细胞膜来降低脂毒性。
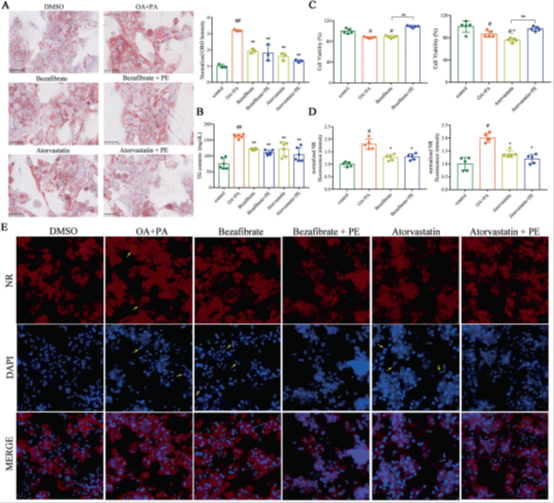
图1促进TG水解和补充PE可改善LXRα-/-小鼠原代肝细胞的脂质蓄积和脂毒性。LXRα-/-小鼠的原代肝细胞在对照溶剂或OA+PA(OA,500 μM;PA,250 μM)刺激下,用降血脂药物(阿托伐他汀或苯扎贝特)处理48小时,并用于以下试验:(A)油红O染色和定量分析图(n=3);比例尺,50 μm;(B)LXRα-/-小鼠原代肝细胞中的TG含量。数据为平均值±标准差(n=6)。与对照组(DMSO)相比,#P < 0.05和##P < 0.01。与OA+PA组比较,*P < 0.05和**P < 0.01。(C)CCK8试验评估细胞活力;数据为平均值±标准差(n=5)。与对照组(DMSO)相比,#P < 0.05和##P < 0.01。与OA+PA组比较,*P < 0.05和**P < 0.01。(D)归一化尼罗红(NR)荧光强度。数据为平均值±标准差(n=5)。与对照组(DMSO)相比,#P < 0.05和##P < 0.01。。与OA+PA组比较,*P < 0.05和**P < 0.01。荧光强度值越高,细胞中的脂质水平越高。(E)LXRα-/-小鼠(n=3)原代肝细胞的中性脂质定位(NR染色)和凋亡细胞核形态学变化(DAPI染色);比例尺,100 μm。
2)天然LXRα小分子诱导剂(冬凌草甲素)改善细胞脂质沉积
鉴于LXRα在HFD诱导的肥胖发展中的关键作用,测试LXRα是否可以靶向预防脂质紊乱是很有意义的。因此,我们研究了小分子冬凌草甲素(ORI)对脂质紊乱的影响。在我们之前的研究中,ORI已被证实为LXRα诱导剂,可增强LXRα表达。在本研究中,我们证明了ORI可以增加LXRα的mRNA和蛋白表达,但siLXRα显著减弱了ORI的这种诱导作用(补充图S9 A-C)。随后,用siLXRα和siControl转染HepG 2细胞,然后在给或不给予ORI处理的情况下,用0.25 mM PA联合0.5 mM OA(OA + PA)处理细胞48 h。ORO染色和细胞TG含量证实ORI减少了细胞脂质沉积(图2A,B)。NR荧光强度和细胞活力检测进一步验证了ORI的降脂和细胞保护作用(图2C、D)。然而,这些作用几乎被siLXRα预处理消除(图2A-D)。此外,给予ORI处理,通过NR染色,我们观察到脂质沉积的抑制和异常核形态变化的消失,而这些效应被siLXRα预处理消除(图2E)。这些结果证实了LXRα在保护脂质稳态方面发挥着重要作用,并表明靶向恢复LXRα表达的小分子药物开发可以改善肥胖诱导的脂质紊乱。
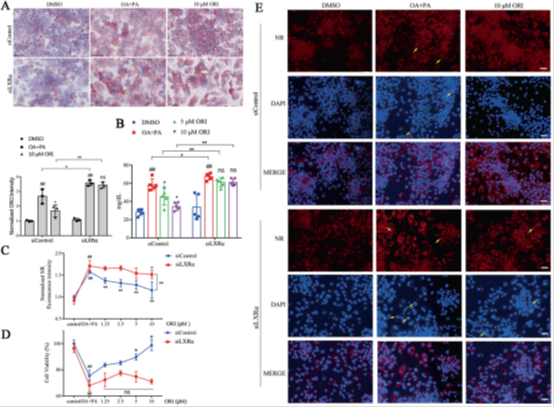
图2天然的LXRα小分子诱导剂(冬凌草甲素)可改善细胞脂质沉积。(A)HepG2细胞转染siLXRα或siControl后,在给或不给予ORI(10 μM)处理的情况下,用0.25 mM PA联合0.5 mM OA(OA + PA)处理细胞48 h,进行油红O染色。比例尺,50 μm。数据为平均值±标准差(n= 3)。与DMSO组比较,#P<0.05和##P< 0.01。与OA+PA组比较,*P < 0.05和**P < 0.01。(B)转染siLXRα或siControl后给予ORI处理的HepG2细胞,对OA和PA的反应。数据为平均值±标准差(n= 5)。与DMSO组比较,#P<0.05和##P< 0.01。与OA+PA组比较,*P < 0.05和**P < 0.01。(C、D)转染siLXRα或siControl后,用不同浓度ORI处理的HepG2细胞的归一化尼罗红(NR)荧光强度和细胞活力。荧光强度值越高,细胞内脂质沉积水平越高。数据为平均值±标准差(n= 5)。与DMSO组比较,#P<0.05和##P< 0.01。与OA+PA组比较,*P < 0.05和**P < 0.01。(E)转染siLXRα或siControl后,给予ORI处理的HepG2细胞,对OA和PA反应的中性脂质定位(NR染色)和凋亡细胞核形态学(n= 3)。比例尺,100 μm。
3)恢复LXRα功能减轻了LXRα缺失对原代肝细胞的有害影响
因此,为了研究LXRα功能的恢复是否能减轻LXRα缺失的有害作用,我们从LXRα−/−小鼠中分离原代肝细胞,在给予对照试剂或OA+PA的情况下,转染M02或LXRα表达质粒。结果显示,LXRα−/−肝细胞的LXRα 功能恢复减弱了脂质沉积和TG水平的增加(图3A、B、D),而PE含量的下降和细胞活力的降低则被消除(图3C、E)。在NR染色和DAPI染色分析中,在LXRα−/−的肝细胞上恢复LXRα功能,显示脂质积累的抑制和异常核形态变化的下降(图3F)。
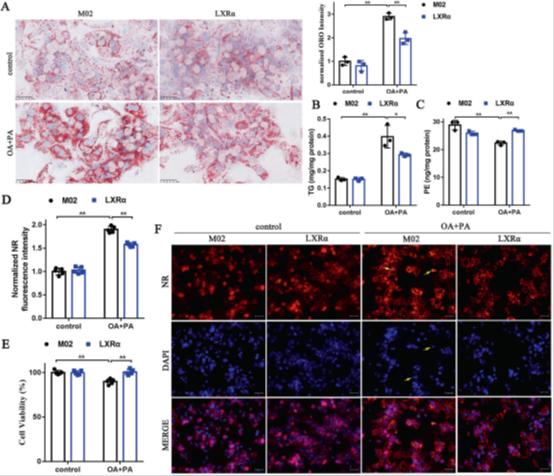
图3 恢复LXRα功能减轻了LXRα缺失对原代肝细胞的有害影响。(A)对LXRα−/−小鼠原代肝细胞进行M02或LXRα表达质粒转染后,给予对照试剂或OA+ PA的油红O染色。比例尺,50 μm。数据为平均值±标准差(n = 3)。*P < 0.05; **P < 0.01。(B,C)LXRα−/−小鼠原代肝细胞进行M02或LXRα表达质粒转染,给予对照试剂或OA+ PA后的TG和PE含量。数据为平均值±标准差(n = 3)。*P < 0.05; **P < 0.01。(D,E)对LXRα−/−小鼠原代肝细胞进行M02或LXRα表达质粒转染后,给予对照试剂或OA+ PA的归一化尼罗红(NR)荧光强度和细胞活力。数据为平均值±标准差(n = 5)。*P < 0.05; **P < 0.01。(F)对LXRα−/−小鼠原代肝细胞进行M02或LXRα表达质粒转染后,给予对照试剂或OA+ PA的中性脂质定位(NR染色)和凋亡细胞核形态学变化(DAPI)。比例尺,100 μm。
4.总结
细胞实验表明,ORI可通过激活LXRα来减少脂质沉积、增强细胞活力和降低脂毒性。此外,LXRα−/−小鼠原代肝细胞的LXRα功能恢复可减弱脂质沉积和TG水平的增加,并消除PE的下降和细胞活力的降低。这些结果表明LXRα在维持脂质稳态中发挥了至关重要的作用。
在膳食脂肪过量的情况下,脂质稳态,特别是TG和PE的平衡被破坏。我们发现,通过LXRα调节TG和PE之间的脂质稳态,可以预防脂肪肝。LXRα通过促进ATGL和EPT1的转录和表达来调节TG和PE之间的动态平衡。这些发现表明,通过LXRα-ATGL/EPT1轴恢复TG和PE之间的平衡可能是脂肪肝的一种可行治疗策略。
小编有话说:
本文采用0.25 mM的棕榈酸(PA)溶液联合0.5 mM的油酸(OA)溶液处理细胞48小时、成功诱导细胞脂质沉积、并建立细胞脂毒性模型。



